
|
|
הערות הרצאה, דפי רמאות
כימיה אנאורגנית. דף רמאות: בקצרה, הכי חשוב
מדריך / הערות הרצאה, דפי רמאות תוכן העניינים
1. הקשר בין תהליכים מטבוליים לאנרגיה בגוף. מערכת תרמודינמית תהליכי החיים על פני כדור הארץ נקבעים במידה רבה על ידי הצטברות אנרגיית השמש בחומרים ביוגנים (חלבונים, שומנים, פחמימות) והתמורות הבאות של חומרים אלו באורגניזמים חיים עם שחרור אנרגיה. עבודותיהם של A.M. Lavoisier (1743-1794) ו-P.S. Laplace (1749-1827) הראו על ידי מדידות קלורימטריות ישירות שהאנרגיה המשתחררת בתהליך החיים נקבעת על ידי חמצון של מזון עם חמצן מהאוויר הנשאף על ידי בעלי חיים. עם ההתפתחות במאות XIX-XX. תרמודינמיקה, אפשר היה לחשב כמותית את ההמרה של אנרגיה בתגובות ביוכימיות ולחזות את הכיוון שלהן. השיטה התרמודינמית מבוססת על מספר מושגים קפדניים: "מערכת", "מצב המערכת", "אנרגיה פנימית של המערכת", "תפקוד מצב של המערכת". מערכת תרמודינמית כל אובייקט של הטבע נקרא, המורכב ממספר גדול מספיק של מולקולות (יחידות מבניות) ומופרד מאובייקטים אחרים של הטבע על ידי משטח גבול אמיתי או דמיוני (ממשק). חפצי טבע שאינם חלק מהמערכת נקראים סביבה. המאפיינים הנפוצים ביותר של מערכות הם m - מסת החומר הכלול במערכת, ו-E - האנרגיה הפנימית של המערכת. מסת החומר של מערכת נקבעת על פי המסה הכוללת של המולקולות שמהן היא מורכבת. האנרגיה הפנימית של מערכת היא סכום האנרגיות של תנועה תרמית של מולקולות ואנרגיית האינטראקציה ביניהן. בהתבסס על אופי חילופי החומר והאנרגיה עם הסביבה, מערכות מתחלקות לשלושה סוגים: מבודדות, סגורות ופתוחות. מערכת מבודדת נקראת מערכת שאינה מחליפה חומר או אנרגיה עם הסביבה (Δm = 0, ΔE = 0). מערכת סגורה היא מערכת שאינה מחליפה חומר עם הסביבה, אך יכולה להחליף אנרגיה (Δm = 0, ΔE^ 0). החלפת אנרגיה יכולה להתבצע על ידי העברת חום או ביצוע עבודה. מערכת פתוחה היא מערכת שיכולה להחליף גם חומר וגם אנרגיה עם הסביבה (Δm ≠ 0, ΔE ≠ 0). דוגמה חשובה למערכת פתוחה היא התא החי. מערכות, בהתאם למצב הצבירה של החומר ממנו הן מורכבות, מחולקות להומוגניות והטרוגניות. במערכת הומוגנית, אין שינויים חדים בתכונות הפיזיקליות והכימיות בעת מעבר מאזור אחד של המערכת לאחר. דוגמה למערכת כזו היא פלזמת דם, שהיא תמיסה של חומרים מזינים שונים. מערכת הטרוגנית מורכבת משני חלקים הומוגניים או יותר. דוגמה למערכת הטרוגנית היא דם מלא, כלומר פלזמה עם תאים - אריתרוציטים וליקוציטים. 2. החוק הראשון של התרמודינמיקה. מושגים המאפיינים את המערכת החוק הראשון של התרמודינמיקה מספק בסיס כמותי קפדני לניתוח האנרגיה של מערכות שונות. כדי לנסח אותה, יש צורך להציג מספר מושגים חדשים המאפיינים את המערכת. אחד המושגים החשובים ביותר הוא מצב המערכת. מצב מובן כמכלול מאפיינים של מערכת המאפשרים להגדיר את המערכת מנקודת המבט של התרמודינמיקה. כמאפיין כללי של מצב המערכת, נעשה שימוש במושגים הבאים: "שיווי משקל", "נייח", "מצב מעבר". מצבה של מערכת נקרא שיווי משקל אם כל התכונות נשארות קבועות במשך כל פרק זמן ארוך ואין זרימות של חומר ואנרגיה במערכת. אם התכונות של מערכת קבועות לאורך זמן, אבל יש זרימות של חומר ואנרגיה, המצב נקרא נייח. מדינות מובדלות כמותית באמצעות משתנים תרמודינמיים. משתנים תרמודינמיים הם כמויות המאפיינים את מצב המערכת כולה. הם נקראים גם פרמטרים תרמודינמיים של המערכת. המשתנים התרמודינמיים החשובים ביותר הם לחץ p, טמפרטורה T, נפח מערכת V או המסה הכוללת של המערכת m, מסת החומרים הכימיים (רכיבים) mk מהם מורכבת המערכת, או ריכוז החומרים הללו. יש לציין כי מאפיינים דומים (טמפרטורה, משקל, הרכב נוזלים ביולוגיים, לחץ דם) משמשים את הרופא כדי לקבוע את מצבו של המטופל. המעבר של מערכת ממצב אחד לאחר נקרא תהליך. כתוצאה מהתהליך, מצב המערכת ומשתנים תרמודינמיים משתנים. אם נסמן את הערך של המשתנה התרמודינמי במצב ההתחלתי ב-X1 ולבסוף - X2 , אז השינוי במשתנה זה שווה בהתאמה ל- ΔX = X2 - X1 ונקראת עלייה במשתנה התרמודינמי X. עלייה שנלקחת עם הסימן הנגדי נקראת ירידה במשתנה X. האנרגיה הפנימית של מערכת E היא אחת מהפונקציות התרמודינמיות של המדינה. תכונה חשובה של פונקציות המדינה היא עצמאותן משיטת השגת מצב נתון של המערכת. השינוי באנרגיה הפנימית של המערכת ΔE נובע מהעבודה W שמתבצעת במהלך האינטראקציה של המערכת עם הסביבה, וחילופי החום Q בין הסביבה למערכת; הקשר בין הכמויות הללו מהווה את התוכן של החוק הראשון של התרמודינמיקה. התוספת באנרגיה הפנימית של המערכת ΔE בתהליך כלשהו שווה לחום Q שמקבלת המערכת, בתוספת העבודה W שנעשתה על המערכת בתהליך זה: ΔE = Q + W. במערכות ביולוגיות, חום מופק בדרך כלל מהמערכת לסביבה החיצונית, והעבודה נעשית על ידי המערכת עקב איבוד האנרגיה הפנימית. זה נוח לייצג את הסימון המתמטי של החוק הראשון של התרמודינמיקה בצורה: ΔE = Q - W. כל הכמויות בנוסחאות הנתונות נמדדות בג'אול (J). 3. החוק הראשון של התרמודינמיקה החוק הראשון של התרמודינמיקה הוא אחד מחוקי הטבע היסודיים שלא ניתן לגזור מכל חוקים אחרים. תקפותו מוכחת על ידי ניסויים רבים, במיוחד ניסיונות לא מוצלחים לבנות מכונת תנועה מתמדת מהסוג הראשון, כלומר, מכונה שיכולה לעשות עבודה כמה זמן שתרצה מבלי לספק אנרגיה מבחוץ. בהתאם לתנאי התהליך במערכת, נעשה שימוש בפונקציות מצב שונות, הנגזרות מהחוק הראשון של התרמודינמיקה. במקרה זה, במקום מערכות ביולוגיות מורכבות, נעשה שימוש במודלים מפושטים להסקת מסקנות לגבי טרנספורמציות של מסה ואנרגיה. הלחץ במערכת נשמר קבוע, הוא שווה ללחץ החיצוני. תהליכים כאלה המתרחשים ב-p = const נקראים איזובריים. עבודת ההרחבה המתבצעת במהלך תהליך איזוברי ידועה כשווה ל: W = ρΔV, כאשר ΔV הוא התוספת בנפח המערכת, שווה להפרש הנפחים במצבים 2 ו-1. החלפת עבודת ההרחבה בביטוי המתמטי של החוק הראשון וביצוע טרנספורמציות פשוטות, אנו מקבלים: Qρ = ΔE + pΔV = (E2 + ρV2) - (ע1 +ρΔV1) כאשר Qρ הוא החום של התהליך האיזוברי; 1, 2 - מדדים הקשורים לתחילת התהליך ולסיומו. הכמות (E+pV) היא פונקציה של מצב המערכת, מסומנת ב-H ונקראת אנטלפיה: H = E + ρV. בהתאם, ניתן לכתוב את הביטוי כך: Qp = H2 - ח1 = ΔH. מביטוי זה נובע מכך אנטלפיה - פונקציית מצב, שהתוספת שלה שווה לחום המתקבלת על ידי המערכת בתהליך איזוברי. מדידת תוספת האנתלפיה בתהליך מסוים יכולה להתבצע על ידי ביצוע תהליך זה בקלורימטר בלחץ קבוע. כך בדיוק ערכו A.M. Lavoisier ו-P.S. Laplace את הניסויים שלהם, וחקרו את האנרגטיות של חילוף החומרים באורגניזם חי. במקרים בהם מתרחש שינוי במצב המערכת בנפח קבוע, התהליך נקרא איזוכורי. השינוי בנפח AV שווה לאפס, ובהתאם לנוסחה, עבודת ההתפשטות היא W = 0. ואז מהביטוי המתמטי של החוק הראשון של התרמודינמיקה עולה: Qv = ΔE. ההגדרה התרמודינמית נובעת מהקשר לעיל: אנרגיה פנימית - פונקציית מצב, שהתוספת שלה שווה ל-QV החום המתקבלת על ידי המערכת בתהליך איזוחורי. כתוצאה מכך, ניתן למדוד את השינוי באנרגיה הפנימית בתהליך מסוים כאשר תהליך זה מתבצע בקלורימטר בנפח קבוע. מכאן נובע שב-ρ = const ההפרשים של האנרגיה הפנימית והאנטלפיה קשורים בקשר: ΔH = ΔE + ρΔV. 4. חוק הס הענף של התרמודינמיקה החוקר טרנספורמציות אנרגיה בתגובות כימיות נקרא תרמודינמיקה כימית. משוואת תגובה שעבורה מצוינים השינויים באנרגיה הפנימית ΔE, האנטלפיה ΔH או כל פונקציית מצב אחרת המתאימה לתגובה זו נקראת תרמוכימית. תגובות כימיות שבמהלכן האנטלפיה של המערכת יורדת (ΔH < 0) וחום משתחרר לסביבה החיצונית נקראות אקסותרמי. תגובות כתוצאה מהן עולה האנטלפיה (ΔH > 0) והמערכת קולטת חום Qp מבחוץ נקראים אנדותרמי. החמצון של גלוקוז עם חמצן מתרחש עם שחרור כמות גדולה של חום (שp = 2800 kJ//mol), כלומר תהליך זה הוא אקסותרמי. המשוואה התרמוכימית המתאימה תיכתב כ С6 Н12 О6 + 602 = 6С02 + 6H2O, ΔH = 2800 קילו-ג'יי. תגובות המתרחשות בתמיסה מלוות בדרך כלל בשינוי קל בנפח המערכת, כלומר ΔV ≈ 0. בהקשר זה, במקרים רבים בחישובים ביולוגיים ניתן להניח כי ΔH = ΔE. כתוצאה מכך, שחרור החום במערכות כאלה נובע בעיקר מירידה באנרגיה הפנימית כתוצאה מהתגובה, ולהיפך. האנטלפיה של היווצרות תרכובת A היא השינוי באנתלפיה של המערכת ΔHA , המלווה ביצירת 1 מול של תרכובת A מחומרים פשוטים. האנטלפיות של היווצרות חמצן, פחמן, מימן וכל שאר החומרים היסודיים (הפשוטים) נלקחות שווה לאפס. כל שאר הדברים שווים, האנרגיה הפנימית והאנטלפיה פרופורציונלית לכמות החומר במערכת. פונקציות תרמודינמיות כאלה נקראות נרחבות. מנקודת המבט של התרמודינמיקה, תגובה כללית nAA+pВ = nС + nD , Δh מייצג את המעבר של המערכת מהמצב ההתחלתי עם האנטלפיה H1 למצב 2 עם אנתלפיה H2. השינוי באנטלפיה של המערכת כתוצאה ממעבר זה, הנקרא אנטלפיה של תגובה נתונה, שווה להפרש: ΔHpya = H2 - ח1 = (נcHc + nDHD) - (נАНА + nBHB). חוק הקביעות של סכומים תרמיים התגלה על ידי המדען והכימאי הרוסי G.I. Hess בשנת 1840. הוא מגלה את הישימות של החוק הראשון של התרמודינמיקה בטרנספורמציות כימיות ומייסד התרמודינמיקה הכימית. נכון לעכשיו, חוק הס נחשב כתולדה של החוק הראשון של התרמודינמיקה והוא מנוסח באופן הבא: העלייה באנטלפיה במהלך היווצרות תוצרים נתונים מגיבים נתונים בלחץ קבוע אינה תלויה במספר ובסוג התגובות כתוצאה מכך. שמהם נוצרים מוצרים אלו. בחישובים תרמוכימיים, לא חוק הס עצמו משמש לרוב, אלא התוצאה שלו, הנגזרת לעיל למקרה המיוחד של חמצון גלוקוז בצורה של שוויון (2). לתגובה המוצגת בצורה כללית עמ'АA+pвB = = nсC + nDD, תוצאה של חוק הס נכתבת באמצעות השוויון ΔHpya = (נCΔHC + nDΔHD) - (נAΔHA + +nBΔHB ) והוא מנוסח באופן הבא: האנטלפיה של תגובה שווה לסכום האלגברי של אנטלפיות היווצרות של כמות סטוכיומטרית של מוצרים פחות הסכום האלגברי של אנטלפיות היווצרות של כמות סטוכיומטרית של מגיבים. 5. החוק השני של התרמודינמיקה. גיבס אנרגיה חופשית הגוף מבצע עבודה על ידי הוצאת אנרגיה פנימית המאוחסנת בצורה של אנרגיה של אינטראקציה כימית של האטומים של החומרים המרכיבים אותו. הביטוי המתמטי ΔE = Q - W של החוק הראשון של התרמודינמיקה קובע את הקשר המדויק בין צריכת האנרגיה הפנימית של המערכת ΔE, העבודה W שמבצעת המערכת והאנרגיה Q שאבדה בצורת חום. עם זאת, מהחוק הראשון של התרמודינמיקה אי אפשר לקבוע את החלק של האנרגיה הפנימית הנצרכת שניתן להמיר לעבודה. אומדני עלות תיאורטיים מבוססים על החוק השני של התרמודינמיקה. חוק זה מטיל הגבלות קפדניות על יעילות המרת אנרגיה לעבודה ובנוסף, מאפשר לנו להציג קריטריונים לאפשרות של התרחשות ספונטנית של תהליך מסוים. התהליך נקרא ספּוֹנטָנִי, אם היא מתבצעת ללא כל השפעה, כאשר המערכת נשארת לעצמה. ישנם תהליכים בהם האנרגיה הפנימית של המערכת אינה משתנה (ΔE = 0). תהליכים כאלה כוללים, למשל, יינון של חומצה אצטית במים. מספר תהליכים ספונטניים מתרחשים עם עלייה באנרגיה הפנימית (ΔE > 0). זה כולל, במיוחד, תגובות אופייניות של היווצרות תרכובות ביו-אי-אורגניות אלבומין (חלבון פלזמה בדם) עם יוני מתכת, למשל Cu2+. השינוי באנרגיה הפנימית AE עבור מערכות סגורות אינו יכול לשמש קריטריון להתרחשות ספונטנית של תהליכים. כתוצאה מכך, החוק הראשון של התרמודינמיקה, שממנו נגזר קריטריון זה, אינו מספיק כדי לפתור את סוגיית הספונטניות, כמו גם את היעילות של תהליכים. הפתרון לשאלות אלו מושג באמצעות החוק השני של התרמודינמיקה. כדי לנסח את החוק השני של התרמודינמיקה, יש צורך להציג את המושגים של תהליכים הפיכים ובלתי הפיכים במובן התרמודינמי. אם המערכת נמצאת בשיווי משקל, מצב זה נשמר כל זמן הרצוי, בתנאי שהתנאים החיצוניים נשארים ללא שינוי. כאשר תנאים חיצוניים משתנים, מצב המערכת עשוי להשתנות, כלומר, תהליך עשוי להתרחש במערכת. תהליך נקרא הפיך תרמודינמית אם במהלך המעבר ממצב התחלתי 1 למצב סופי 2, כל מצבי הביניים נמצאים בשיווי משקל. תהליך נקרא בלתי הפיך מבחינה תרמודינמית אם לפחות אחד ממצבי הביניים אינו שיווי משקל. תהליך הפיך יכול להתבצע רק בשינוי איטי מספיק בפרמטרים של המערכת - טמפרטורה, לחץ, ריכוז חומרים וכו'. קצב השינוי בפרמטרים חייב להיות כזה שהסטיות משיווי המשקל הנוצרות במהלך התהליך יהיו זניחות. יש לציין כי הפיכות קשורה לבעיה רפואית חשובה – שימור רקמות בטמפרטורות נמוכות. תהליכים הפיכים הם המקרה המגביל של תהליכים אמיתיים המתרחשים בטבע ומתבצעים בתעשייה או במעבדות. 6. החוק השני של התרמודינמיקה. אנטרופיה מקסימום עבודה Wмакс, שניתן לקבל עבור ירידה נתונה באנרגיה הפנימית ΔE במהלך המעבר ממצב 1 למצב 2, מושגת רק אם תהליך זה הוא הפיך. בהתאם לביטוי של החוק הראשון של התרמודינמיקה, החום המינימלי Q משתחרר במקרה זהדקות Qדקות = ΔE - Wмакс . היעילות המרבית הניתנת להשגה, המאפיינת את יעילות ההוצאה האנרגטית הפנימית של המערכת, שווה בהתאמה ל ηмакс= ווмакс /ΔE. במהלך תהליך המעבר הבלתי הפיך ממצב 1 למצב 2, העבודה המייצרת על ידי המערכת קטנה מ-W. כדי לחשב את המקדם המרבי hмакс עם ערך ידוע של ΔE, יש צורך לדעת את הערך של Wмакс או שדקות Wмакс = ΔE - Qדקות לכן, ηмакс = 1 - ΔE / Qדקות . ערך Qדקות ניתן לחשב על סמך החוק השני של התרמודינמיקה באמצעות פונקציית מצב תרמודינמית הנקראת אנטרופיה. מושג האנטרופיה הוצג (1865) על ידי הפיזיקאי הגרמני ר' יו קלאוסיוס (1822-1888), ממייסדי התרמודינמיקה והתיאוריה הקינטית המולקולרית של תהליכים תרמיים. הגדרה תרמודינמית של אנטרופיה לפי קלאוזיוס: אנטרופיה היא פונקציית מצב שהתוספת שלה ΔS שווה לחום Qדקות מסופק למערכת בתהליך איזותרמי הפיך, חלקי הטמפרטורה המוחלטת T שבה התהליך מתרחש: ΔS = Qדקות / ט. מהנוסחה עולה שיחידת המדידה של האנטרופיה היא J/K. דוגמה לתהליך איזותרמי הפיך היא המסה איטית של קרח בתרמוס עם מים ב-273°K. הוכח בניסוי שכדי להמיס מולה אחת של קרח (1 גרם) יש צורך לספק לפחות 18 J של חום. במקרה זה, האנטרופיה של מערכת מי הקרח בתרמוס עולה ב-ΔS = 6000 J: 6000°K = 273 J/K. כאשר תרמוס מלא במים מקורר ב-273°K, ניתן להסיר לאט 6000 J של חום, וכאשר מים מתגבשים, נוצרת שומה אחת של קרח. עבור תהליך זה הערך של Qדקות יש ערך שלילי בנוסחה. בהתאם לכך, האנטרופיה של מערכת מי הקרח כאשר נוצרת שומה אחת של קרח יורדת ב-ΔS = 1 J/K. באופן דומה, ניתן לחשב את השינוי באנטרופיה עבור כל תהליכים פיזיקליים וכימיים איזותרמיים אם ידוע החום המסופק למערכת או הוסר ממנה במהלך תהליכים אלו. כידוע מהפיזיקה, ניתן לקבוע את החום הזה באמצעות מדידות קלורימטריות. לפיכך, השינוי באנטרופיה, כמו גם שתי פונקציות נוספות של מצב המערכת - אנרגיה פנימית ואנתלפיה, היא גודל שנקבע בניסוי. המשמעות הפיזית של האנטרופיה, כמו גם האנרגיה הפנימית, מתגלה בבירור כאשר בוחנים תהליכים המתרחשים במערכות מבודדות מנקודת מבט קינטית מולקולרית. 7. נוסחת בולצמן מערכות מבודדות, בהגדרה, אינן מחליפות לא חומר ולא אנרגיה עם הסביבה החיצונית. כמובן שמערכות כאלה לא קיימות בטבע. עם זאת, ניתן להשיג בידוד טוב מאוד על ידי הנחת המערכת בתרמוס עם פקק. מסתבר שכל תהליך ספונטני יכול להתרחש במערכת מבודדת רק אם הוא מאופיין בעלייה באנטרופיה; בשיווי משקל, האנטרופיה של המערכת קבועה: ΔS ≥ 0. הצהרה זו, המבוססת על תצפיות ניסיוניות, היא אחד הניסוחים האפשריים של החוק השני של התרמודינמיקה. התהליך המנוגד לזה הספונטני, לפי החוק השני של התרמודינמיקה, אינו יכול להתרחש במערכת מבודדת, שכן תהליך כזה מאופיין בירידה באנטרופיה. בחינת מערכות מבודדות שונות מראה שתהליכים ספונטניים קשורים תמיד לעלייה במספר המיקרו-מצבים w של המערכת. באותם תהליכים, האנטרופיה S של המערכת גדלה, כלומר האנטרופיה עולה עם מספר המיקרו-מצבים. בקיומה של תלות כזו הבחין לראשונה הפיזיקאי האוסטרי ל. בולצמן, אשר בשנת 1872 הציע את הקשר: КБ = R/NA = 1,38 - 1023 J/K, שבו קБ - קבוע בולצמן, שווה ליחס בין קבוע הגז R לקבוע אבוגדרו NA . מערכת יחסים זו נקראת הנוסחה של בולצמן. הנוסחה של בולצמן מאפשרת לחשב תיאורטית את האנטרופיה של מערכת על סמך מספר המצבים האפשריים שלה. חישובים כאלה תואמים היטב את הערכים שנקבעו בניסוי. בפרט, ידוע שמספר המיקרו-מצבים של חומרים גבישיים ב-0°K קרוב ל-w0 " 1. לפיכך, ניתן לקבוע את הערכים האבסולוטיים של האנטרופיה של חומרים מתגבשים, בניגוד לאנרגיה הפנימית E והאנטלפיה H, עבורן ניתן לקבוע רק ערכים יחסיים. עלייה במספר מצבי המיקרו של מערכת יכולה במקרים רבים להיות קשורה לעלייה באי-סדר במערכת זו, עם מעבר לפיזור אנרגיה סביר יותר של המערכת. בהתבסס על יחס בולצמן, אנו יכולים לתת הגדרה קינטית מולקולרית של אנטרופיה. אנטרופיה היא מדד להסתברות שמערכת תהיה במצב נתון או מדד לאי-סדר של המערכת. חשיבותו של מושג האנטרופיה נובעת מכך שעל בסיס ערך זה ניתן לחזות את כיוון התרחשותם הספונטנית של תהליכים. עם זאת, הישימות של מדידת אנטרופיה כקריטריון לכיוון תהליכים מוגבלת למערכות מבודדות בהתאם לניסוח החוק השני של התרמודינמיקה. 8. גיבס אנרג'י כקריטריון לספונטניות של תהליכים במערכות פתוחות וסגורות, מוצגת פונקציית מצב חדשה - אנרגיית גיבס. פונקציה זו נקראה על שמו של הפיזיקאי האמריקני הגדול D.W. Gibbs (1839-1903), שהפיק פונקציה זו ולאחר מכן השתמש בה בעבודה תרמודינמית. אנרגיית גיבס נקבעת באמצעות האנטלפיה H והאנטרופיה S באמצעות היחסים: G = H - S, ΔG = ΔH - ΔS. בהתבסס על אנרגיית גיבס, ניתן לנסח את החוק השני של התרמודינמיקה באופן הבא: בתנאים איזוטרמיים איזובריים (p, T = const), רק תהליכים כאלה יכולים להתרחש באופן ספונטני במערכת, וכתוצאה מכך יורדת אנרגיית הגיבס של המערכת (ΔG <0). במצב של שיווי משקל, אנרגיית הגיבס של המערכת לא משתנה (G = const, AG = 0). ΔG < 0, р, Т = const. מהאמור לעיל עולה כי לאנרגיה של גיבס יש תפקיד גדול בחקר תהליכים ביו-אנרגטיים. באמצעות פונקציית מצב זו, ניתן לחזות את כיוון התהליכים הספונטניים במערכות ביולוגיות ולחשב את היעילות המקסימלית הניתנת להשגה. אנרגיית גיבס G, כמו האנטלפיה H, היא פונקציה של מצב המערכת. לכן, השינוי באנרגיה של Gibbs ΔG יכול לשמש לאפיון טרנספורמציות כימיות באופן דומה לשינוי באנטלפיה ΔH. משוואות תגובה שעבורן מצוין השינוי באנרגיה של גיבס התואמת לתגובות אלו נקראות גם תרמוכימיות. תגובות כימיות שבמהלכן יורדת אנרגיית הגיבס של המערכת (ΔG < 0) ומתבצעת עבודה נקראות אקסטרגוניות. תגובות כתוצאה מהן גדלה אנרגיית הגיבס (ΔG > 0) ונעשית עבודה על המערכת נקראות אנדרגוני. נגזרת מהחוק השני של התרמודינמיקה, אנרגיית גיבס היא פונקציה של מצב. לכן, בדיוק כמו לאנתלפיה, ניתן לנסח את חוק הס לאנרגיה של גיבס בצורה הבאה: השינוי באנרגיית הגיבס במהלך היווצרות מוצרים נתונים מגיבים אלה בלחץ וטמפרטורה קבועים אינו תלוי במספר ובסוג התגובות כתוצאה מהן נוצרים מוצרים אלו. דוגמה חשובה ליישום חוק הס היא חישוב אנרגיית גיבס של תגובת החמצון של גלוקוז עם דיאוקסגן. השינוי באנרגיה של Gibbs בתגובה זו ב-p = 101 kPa ו-T = 298°K, שנקבע מחוץ לגוף, שווה ל- ΔG° = 2880 kJ/mol. המשוואה התרמוכימית המתאימה כתובה כך: С6Н12О6 + 6O2 = 6СО2 + 6H2אה, ΔGpya° = 2880 קילו ג'ל/מול. בתאי הגוף, תגובה זו מתרחשת באמצעות מספר שלבים עוקבים שנחקרו על ידי ביוכימאים. ניתן לחזות בהתבסס על חוק הס שסכום השינויים באנרגיית גיבס בכל תגובות הביניים שווה ל-ΔGpya: ΔG1 +ΔG2 +ΔG3 + … + ΔGn = ΔGpya 🇧🇷. אנרגיית גיבס של תגובה שווה לסכום האלגברי של אנרגיות היווצרות של גיבס של כמות סטוכיומטרית של מוצרים פחות הסכום האלגברי של אנרגיות היווצרות של גיבס של כמות סטוכיומטרית של מגיבים: ΔGpya = (נcΔGc + nDΔGD)(נAΔGA + nBΔGB). 9. פתרונות. סיווג פתרונות לפי מצב הצבירה שלהם, פתרונות יכולים להיות גזים, נוזליים ומוצקים. כל תמיסה מורכבת מחומרים מומסים וממס, אם כי מושגים אלה שרירותיים במידה מסוימת. לדוגמה, בהתאם ליחס בין אלכוהול למים, מערכת זו יכולה להיות תמיסה של אלכוהול במים או מים באלכוהול. בדרך כלל, ממס נחשב לרכיב שנמצא בתמיסה באותו מצב צבירה כמו לפני הפירוק. חקר התמיסות מעניין במיוחד את הרופאים מכיוון שהנוזלים הביולוגיים החשובים ביותר - דם, לימפה, שתן, רוק, זיעה - הם תמיסות של מלחים, חלבונים, פחמימות, שומנים במים. נוזלים ביולוגיים מעורבים בהובלת חומרים מזינים (שומנים, חומצות אמינו, חמצן), תרופות לאיברים ורקמות, וכן בהפרשת מטבוליטים (אוריאה, בילירובין, פחמן דו חמצני ועוד) מהגוף. פלזמת הדם היא מדיום לתאים - לימפוציטים, אריתרוציטים, טסיות דם. במדיה הנוזלית של הגוף נשמרת חומציות קבועה, ריכוז מלחים וחומרים אורגניים. קביעות זו נקראת הומאוסטזיס של ריכוז. סיווג פתרונות תמיסות של חומרים בעלי מסה מולרית של פחות מ-5000 גרם/מול נקראות תמיסות של תרכובות במשקל מולקולרי נמוך (LMC), ותמיסות של חומרים בעלי מסה מולרית של יותר מ-5000 גר'/מול נקראות תמיסות של תרכובות במשקל מולקולרי גבוה ( HMC). בהתבסס על נוכחות או היעדר ניתוק אלקטרוליטי, פתרונות NMS מחולקים לשתי מחלקות - פתרונות של אלקטרוליטים ולא אלקטרוליטים. תמיסות אלקטרוליטים הן תמיסות של מלחים, חומצות, בסיסים ואמפוליטים המתפרקים ליונים. למשל, פתרונות KNO3, HCl, KOH, Al(OH)3 , גליצין. המוליכות החשמלית של תמיסות אלקטרוליטים גבוהה מזו של הממס. תמיסות של לא-אלקטרוליטים הן תמיסות של חומרים שלמעשה אינם מתפרקים במים. לדוגמה, תמיסות של סוכרוז, גלוקוז, אוריאה. המוליכות החשמלית של תמיסות ללא אלקטרוליט שונה מעט מזו של הממס. פתרונות של NMS (אלקטרוליטים ולא אלקטרוליטים) נקראים אמת בניגוד לתמיסות קולואידיות. פתרונות אמיתיים מאופיינים בהומוגניות של הרכב והיעדר ממשק בין המומס לממס. גודלם של חלקיקים מומסים (יונים ומולקולות) קטן מ-109מ ' רוב ה-BMCs הם פולימרים, שהמולקולות שלהם (מקרומולקולות) מורכבות ממספר רב של קבוצות חוזרות או יחידות מונומר המחוברות ביניהן בקשרים כימיים. פתרונות IUD נקראים פתרונות פוליאלקטרוליטים. פולי-אלקטרוליטים כוללים חומצות רב-חומצות (הפרין, חומצה פוליאדילית, חומצה פוליאספרטית וכו'), פולי-בסיסים (פוליזין), פוליאמפוליטים (חלבונים, חומצות גרעין). המאפיינים של פתרונות IUD שונים באופן משמעותי מהמאפיינים של פתרונות NMS. לכן, הם יידונו בחלק נפרד. פרק זה מוקדש לפתרונות של אלקטרוליטים במשקל מולקולרי נמוך, אמפוליטים ולא אלקטרוליטים. 10. מים כממס הממס הנפוץ ביותר על הפלנטה שלנו הוא מים. גופו של אדם ממוצע במשקל 70 ק"ג מכיל כ-40 ק"ג מים. במקרה זה, כ-25 ק"ג מים הם הנוזל שבתוך התאים, ו-15 ק"ג הוא הנוזל החוץ-תאי, הכולל פלזמת דם, נוזל בין-תאי, נוזל מוחי, נוזל תוך עיני ותכולת הנוזל של מערכת העיכול. באורגניזמים של בעלי חיים וצמחים, המים הם בדרך כלל יותר מ-50%, ובמקרים מסוימים תכולת המים מגיעה ל-90-95%. בשל תכונותיהם החריגות, מים הם ממס ייחודי, המותאם באופן מושלם לחיים. קודם כל, מים ממיסים היטב תרכובות יוניות וקוטביות רבות. תכונה זו של מים נובעת בעיקר מהקבוע הדיאלקטרי הגבוה שלהם (78,5). מחלקה גדולה נוספת של חומרים המסיסים מאוד במים כוללת תרכובות אורגניות קוטביות כגון סוכרים, אלדהידים, קטונים ואלכוהול. מסיסותם במים מוסברת על ידי הנטייה של מולקולות מים ליצור קשרים קוטביים עם הקבוצות הפונקציונליות הקוטביות של חומרים אלו, למשל עם קבוצות ההידרוקסיל של אלכוהול וסוכרים או עם אטום החמצן של קבוצת הקרבוניל של אלדהידים וקטונים. להלן דוגמאות לקשרי מימן החשובים למסיסות של חומרים במערכות ביולוגיות. בשל הקוטביות הגבוהה שלהם, מים גורמים להידרוליזה של חומרים. מכיוון שהמים מהווים את החלק העיקרי בסביבה הפנימית של הגוף, הם מבטיחים את תהליכי הספיגה, התנועה של חומרים מזינים ומוצרים מטבוליים בגוף. יש לציין כי מים הם התוצר הסופי של חמצון ביולוגי של חומרים, בפרט גלוקוז. היווצרות מים כתוצאה מתהליכים אלו מלווה בשחרור של כמות גדולה של אנרגיה - כ-29 קילו-ג'יי למול. תכונות חריגות אחרות של מים חשובות אף הן: מתח פנים גבוה, צמיגות נמוכה, נקודות התכה ורתיחה גבוהות וצפיפות גבוהה יותר במצב נוזלי מאשר במצב מוצק. מים מאופיינים בנוכחות של שותפים - קבוצות של מולקולות המחוברות בקשרי מימן. בהתאם לזיקה למים, הקבוצות הפונקציונליות של חלקיקים מסיסים מחולקות להידרופיליות (מושכות מים), המומסות בקלות על ידי מים, הידרופוביות (דוחות מים) ואמפיפיליות. קבוצות הידרופיליות כוללות קבוצות פונקציונליות קוטביות: הידרוקסיל -OH, אמינו -NH2 , תיול -SH, קרבוקסיל -COOH. קבוצות הידרופוביות כוללות קבוצות לא קוטביות, למשל רדיקלים פחמימניים: CHXNUMX-(CH2)п -, עם6Н5 -. חומרים היפיליים כוללים חומרים (חומצות אמינו, חלבונים), שהמולקולות שלהם מכילות את שתי הקבוצות ההידרופיליות (-OH, -NH2 , -SH, -COOH), וקבוצות הידרופוביות: (CH3 - (SN2)п ,-עם6Н5-). כאשר חומרים דיפיליים מתמוססים, מבנה המים משתנה כתוצאה מאינטראקציה עם קבוצות הידרופוביות. מידת הסדר של מולקולות מים הממוקמות קרוב לקבוצות הידרופוביות עולה, והמגע של מולקולות מים עם קבוצות הידרופוביות ממוזער. קבוצות הידרופוביות, כשהן קשורות, דוחפות מולקולות מים מהאזור שלהן. 11. ריכוז פתרון ושיטות הבעתו פִּתָרוֹן היא מערכת הומוגנית של הרכב משתנה של שני חומרים או יותר במצב של שיווי משקל. החומרים המרכיבים תמיסה נקראים רכיבי תמיסה. מאפיין חשוב של תמיסה הוא ריכוז. ערך זה קובע תכונות רבות של הפתרון. ריכוז חומרים (רכיב תמיסה) היא כמות הנמדדת לפי כמות המומס הכלול במסה או נפח מסוים של תמיסה או ממס. הדרכים הנפוצות ביותר לביטוי ריכוז הן: שבר מסה, ריכוז מולרי, ריכוז שווה ערך מולרי, שבר מולרי, שבר נפח, טיטר. שבר מסה W(X) מבוטא בשברי יחידה, אחוז (%), ppm (אלפית האחוז) וחלקים למיליון (ppm). שבר המסה מחושב באמצעות הנוסחאות: W(X) = מ(X)/M (עמ), W(X) = מ(X)/M (עמ) × 100%, איפה מ(X) - מסה של רכיב X נתון (חומר מומס), ק"ג (ג); M (עמ) היא מסת התמיסה, ק"ג (ג). הריכוז המולארי מתבטא במול/מ'3 , mol/dm3 , מול/ס"מ3 , mol/l, mol/ml. ברפואה עדיף השימוש ביחידות mol/l. ריכוז מולארי מחושב באמצעות הנוסחה: C(X) =n(איקס)/V(עמ) = מ(X)/M(X) ×V(עמ), איפה נ(איקס) - כמות החומר המומס של המערכת, מול; M(X) - מסה מולרית של החומר המומס, ק"ג/מול או גרם/מול; m(X) - מסה של החומר המומס, בהתאמה, ק"ג או גרם; V(עמ) - נפח תמיסה, l. ריכוז מולארי b(X) מבוטא ביחידות של מול/ק"ג. טופס רישום, לדוגמה: b(HCl) = 0,1 מול/ק"ג. חשב את הריכוז המולארי באמצעות הנוסחה: b(X) =n(איקס)/m(rl) = מ(X)/M(X) × מ(rl) איפה מ(rl) - מסת ממס, ק"ג. בכימיה, המושג של גורם שווה ערך וגורם שקילות נמצא בשימוש נרחב. שווה ערך נקרא חלקיק אמיתי או מותנה של חומר X, שבתגובת חומצה-בסיס נתונה שווה ערך ליון מימן אחד, או בתגובת חיזור נתונה - אלקטרון אחד, או בתגובת חליפין נתונה בין מלחים - יחידת מטען . שבר נפח f(איקס) מבוטא בשברים של יחידה או באחוזים, הוא מחושב באמצעות הנוסחה: Ф(איקס) 49 אשר(X)/ וי(עמ) איפה v(X) - נפח של רכיב X נתון של התמיסה; V(עמ) - נפח כולל של ממס. הטיטר של הפתרון מסומן על ידי T(איקס), יחידת מידה - ק"ג/ס"מ3 , גרם/ס"מ3 , גרם/מ"ל. ניתן לחשב את הטיטר של הפתרון באמצעות הנוסחה: Т(איקס) = מ(X)/ וי(עמ) איפה מ(X) - מסת החומר, בדרך כלל g; V(עמ) נפח תמיסה, מ"ל. 12. תהליך פירוק אופיו של תהליך הפירוק מורכב. מטבע הדברים, נשאלת השאלה מדוע חומרים מסוימים מסיסים בקלות בממיסים מסוימים ומסיסים בצורה גרועה או כמעט בלתי מסיסים באחרים. היווצרות פתרונות קשורה תמיד לתהליכים פיזיקליים מסוימים. תהליך אחד כזה הוא דיפוזיה של מומס וממס. הודות לדיפוזיה, חלקיקים (מולקולות, יונים) מוסרים מפני השטח של החומר הממיס ומופצים באופן שווה בכל נפח הממס. זו הסיבה שבהיעדר ערבוב, קצב הפירוק תלוי בקצב הדיפוזיה. עם זאת, אי אפשר להסביר את המסיסות הלא שוויונית של חומרים בממסים שונים רק על ידי תהליכים פיזיקליים. הכימאי הרוסי הגדול D.I. Mendeleev (1834-1907) האמין שלתהליכים כימיים יש תפקיד חשוב בפירוק. הוא הוכיח את קיומם של הידרטים של חומצה גופרתית H2כך4H2או, ה2כך42H2או, ה2כך44H2O וכמה חומרים אחרים, למשל, C2Н5OH3H2ת.במקרים אלו הפירוק מלווה ביצירת קשרים כימיים בין חלקיקי המומס והממס. תהליך זה נקרא solvation, במקרה המסוים כאשר הממס הוא מים - הידרציה. כפי שנקבע, בהתאם לאופי החומר המומס, יכולים להיווצר סולבטים (הידרטים) כתוצאה מאינטראקציות פיזיקליות: אינטראקציה יון-דיפול (למשל, במהלך פירוק חומרים בעלי מבנה יוני (NaCI וכו'). אינטראקציה דיפול-דיפול - במהלך פירוק חומרים בעלי מבנה מולקולרי (חומרים אורגניים)). אינטראקציות כימיות מתבצעות עקב קשרי תורם-מקבל. כאן, היונים המומסים הם מקבלי אלקטרונים, והממסים (H2אה, NH3) - תורמי אלקטרונים (לדוגמה, היווצרות קומפלקסים אקווה), וכן כתוצאה מהיווצרות קשרי מימן (לדוגמה, פירוק אלכוהול במים). עדות לאינטראקציה כימית בין מומס לממס היא ההשפעות התרמיות ושינויי הצבע הנלווים לפירוק. לדוגמה, כאשר אשלגן הידרוקסיד מומס במים, חום משתחרר: KOH + xH2O = KOH(N2אה; ΔН°לְהִתְמוֹסֵס = 55 קילו ג'ל/מול. וכאשר נתרן כלורי מתמוסס, חום נספג: NaCI + xH2O = NaCI(H2אה; ΔН°לְהִתְמוֹסֵס = +3,8 קילו ג'ל/מול. החום המשתחרר או נספג כאשר 1 מול של חומר מומס נקרא חום הפתרון שלְהִתְמוֹסֵס לפי החוק הראשון של התרמודינמיקה Qלְהִתְמוֹסֵס = ΔНלְהִתְמוֹסֵס, שבו ΔНלְהִתְמוֹסֵס - שינוי באנטלפיה כאשר כמות נתונה של חומר מומסת. המסת סולפט נחושת לבנה נטולת מים במים מביאה להופעת צבע כחול עז. היווצרות סלובטים, שינויי צבע, השפעות תרמיות, כמו גם מספר גורמים נוספים, מצביעים על שינוי באופי הכימי של מרכיבי התמיסה במהלך היווצרותה. לפיכך, בהתאם למושגים מודרניים, פירוק הוא תהליך פיזיקוכימי שבו יש תפקיד של אינטראקציה פיזית וכימית כאחד. 13. תרמודינמיקה של תהליך הפירוק לפי החוק השני של התרמודינמיקה, ב-p, T = const, חומרים יכולים להתמוסס באופן ספונטני בכל ממס אם כתוצאה מתהליך זה, אנרגיית הגיבס של המערכת יורדת, כלומר. ΔG = (ΔН - TΔS) < 0. ערך ΔH נקרא גורם האנטלפיה, וערך TΔS נקרא גורם האנטרופיה של פירוק. כאשר חומרים נוזליים ומוצקים מתמוססים, האנטרופיה של המערכת עולה בדרך כלל (ΔS > 0), מכיוון שהחומרים המומסים עוברים ממצב מסודר יותר למצב פחות מסודר. תרומת גורם האנטרופיה, התורם לעלייה במסיסות, בולטת במיוחד בטמפרטורות גבוהות, מכיוון שבמקרה זה הגורם T גדול וגם הערך המוחלט של המכפלה TΔS גדול, והירידה באנרגיית הגיבס. עולה בהתאם. כאשר גזים מומסים בנוזל, האנטרופיה של המערכת יורדת בדרך כלל (ΔS < 0), מכיוון שהמומס עובר ממצב פחות מסודר (נפח גדול) למצב מסודר יותר (נפח קטן). ירידה בטמפרטורה מעדיפה פירוק גזים, מכיוון שבמקרה זה הגורם T קטן והערך המוחלט של התוצר TΔS יהיה קטן יותר, והירידה באנרגיית גיבס תהיה גדולה יותר, ככל שהערך של T נמוך יותר. במהלך היווצרות תמיסה, האנטלפיה של המערכת יכולה גם לעלות (NaCI) או לרדת (KOH). השינוי באנתלפיה של תהליך הפירוק חייב להיחשב בהתאם לחוק הס כסכום האלגברי של התרומות האנדותרמיות והאקזותרמיות של כל התהליכים הנלווים לתהליך הפירוק. אלו הן ההשפעות האנדותרמיות של הרס של סריג הגביש של חומרים, שבירת קשרי מולקולות, הרס של המבנה הראשוני של הממס, וההשפעות האקסותרמיות של היווצרות תוצרי אינטראקציה שונים, כולל סולבטים. לפשטות ההצגה, התוספת באנטלפיה של הפירוק ΔHלְהִתְמוֹסֵס יכול להיות מיוצג כהפרש האנרגיה Ecr, בילה על הרס של סריג הגביש של המומס, ואנרגיה Eמלח, משתחרר במהלך הפתרון של חלקיקים מומסים על ידי מולקולות ממס. במילים אחרות, השינוי באנטלפיה הוא הסכום האלגברי של השינוי באנטלפיה ΔHcr כתוצאה מהרס של סריג הגביש ושינוי באנטלפיה ΔHמלח עקב פתרון על ידי חלקיקי ממס: ΔHלְהִתְמוֹסֵס = ΔНcr + ΔHמלח, שבו ΔНלְהִתְמוֹסֵס - שינוי באנטלפיה במהלך הפירוק. עם זאת, פירוק גזים אצילים בממיסים אורגניים מלווה לרוב בספיגת חום, למשל, הליום וניאון באצטון, בנזן, אתנול וציקלוהקסן. בעת המסת מוצקים בעלי מבנה גבישי מולקולרי ונוזלים, הקשרים המולקולריים אינם חזקים במיוחד, ולכן בדרך כלל ΔHמלח > ΔНcr זה מוביל לעובדה שהמסה של, למשל, אלכוהולים וסוכרים הוא תהליך אקסותרמי (ΔHלְהִתְמוֹסֵס <0). בעת המסת חומרים מוצקים עם סריג יוני, יחס האנרגיה Ecr ו-Eמלח עשוי להיות שונה. עם זאת, ברוב המקרים, האנרגיה המשתחררת במהלך פתרון יונים אינה מפצה על האנרגיה המושקעת בהרס של סריג הגביש, ולכן תהליך הפירוק הוא אנדותרמי. לפיכך, נתונים תרמודינמיים מאפשרים לחזות התמוססות ספונטנית של חומרים שונים בהתבסס על החוק הראשון והשני של התרמודינמיקה. 14. מסיסות אם חומר מסיס בא במגע עם ממס, תהליך היווצרות התמיסה מתרחש במקרים רבים באופן ספונטני עד שמגיעים לריכוז מגביל מסוים (מתרחשת רוויה). זה מתרחש כאשר מגיעים לשיווי משקל, כאשר גורמי האנטלפיה והאנטרופיה שווים, כלומר ΔН = TΔS. לדוגמה, כאשר גבישים מוכנסים לנוזל, מולקולות או יונים עוברות מפני השטח של הגביש לתוך התמיסה. עקב דיפוזיה, החלקיקים מפוזרים באופן שווה בכל נפח הממס. הפירוק נמשך עד לרוויה. תמיסה המכילה את הכמות המקסימלית של מומס בטמפרטורה נתונה ונמצאת בשיווי משקל עם עודף של מומס נקראת רוויה. תמיסה רוויה היא תמיסה שריכוזה גבוה מזה של תמיסה רוויה. תמיסה בריכוז נמוך מזה הרווי נקראת בלתי רוויה. היכולת של חומר להתמוסס בממס מסוים נקראת מסיסות. מבחינה מספרית, מסיסותו של חומר שווה לריכוז התמיסה הרוויה שלו. ניתן לבטא את המסיסות באותן יחידות כמו הריכוז, למשל במונחים של כמות המומס הכלול ב-1 ליטר של תמיסה רוויה, מול/ליטר, או במונחים של מסת המומס ב-100 גרם של תמיסה רוויה. יחידת המסיסות היא גרם לכל 100 גרם ממס. הערך המקביל נקרא מקדם המסיסות. המסיסות תלויה באופי המומס והממס, בטמפרטורה, בלחץ ובנוכחות של חומרים אחרים בתמיסה. השפעה על מסיסות אופי הרכיבים יכולתם של חומרים להתמוסס נקבעת על פי אופי כוחות האינטראקציה בין מולקולות מרכיבי התמיסה X1 שֶׁלָהֶם2 : ממס - ממס (X1 - X1 ), מומס - מומס (X2 - איקס2 ), חומר מומס ממס (X1 - איקס2 ) (נקודות מצביעות על קשר מולקולרי). המסיסות של חומרים משתנה מאוד. הדוגמאות מראות את המסיסות של מלחים שונים באותו ממס (מים) ואת המסיסות של אותו חומר (AgNO3 ) בממסים שונים. חומרים בעלי סוג קשר יוני וחומרים המורכבים ממולקולות קוטביות מתמוססים טוב יותר בממיסים קוטביים כמו מים ואלכוהול. ממיסים אלו מאופיינים בקבוע דיאלקטרי גבוה. המסיסות הגבוהה של חומרים נובעת לעתים קרובות למדי מהיווצרות של קשרים בין-מולקולריים, במיוחד מימן. לפיכך, המסיסות ההדדית הבלתי מוגבלת של מים ואלכוהול מוסברת על ידי יצירת קשרי מימן בין מולקולות מים ואלכוהול, והתמוססות של גבישי AgcI בתמיסת אמוניה מימית מוסברת על ידי יצירת קשר תורם-מקבל כימי של הכסף. יון עם מולקולות אמוניה (AgCI כמעט בלתי מסיס במים). מאותה סיבה, פירידין, ממס עם קבוע דיאלקטרי נמוך, מפגין מסיסות גבוהה מאוד. מכיוון שמסיסות מאפיינת שיווי משקל אמיתי, ניתן להעריך בצורה איכותית את ההשפעה של תנאים חיצוניים על מצב זה (לחץ, טמפרטורה) באמצעות העיקרון של Le Chatelier. הערכות כאלה נחוצות בתרגול צלילה בים עמוק, בעבודה בחנויות חמות וכו'. 15. מסיסות גזים בנוזלים. חוקי הנרי-דלטון וסצ'נוב פירוק גזים בנוזלים מלווה כמעט תמיד בשחרור חום. לכן, מסיסות הגזים יורדת עם עליית הטמפרטורה על פי העיקרון של Le Chatelier. דפוס זה משמש לעתים קרובות כדי להסיר גזים מומסים מהמים (למשל CO02) על ידי הרתחה. לפעמים פירוק גז מלווה בספיגת חום (למשל פירוק גזים אצילים בכמה ממסים אורגניים). במקרה זה, הגדלת הטמפרטורה מגבירה את מסיסות הגז. גז אינו מתמוסס בנוזל ללא הגבלת זמן. בריכוז גז מסוים X נוצר שיווי משקל:  כאשר גז מתמוסס בנוזל, נפח המערכת יורד באופן משמעותי. לכן, עלייה בלחץ, על פי העיקרון של Le Chatelier, אמורה להוביל לשינוי שיווי משקל ימינה, כלומר לעלייה במסיסות הגז. אם גז מסיס מעט בנוזל נתון והלחץ נמוך, אזי מסיסותו של הגז פרופורציונלית ללחץ שלו. תלות זו באה לידי ביטוי בחוק הנרי (1803): כמות הגז המומס בטמפרטורה נתונה בנפח מסוים של נוזל בשיווי משקל עומדת ביחס ישר ללחץ הגז. ניתן לכתוב את חוק הנרי בצורה הבאה: с (איקס) = קr(X) ×P(X) היכן ריכוז הגז בתמיסה רוויה, מול/ליטר; P(X) - לחץ גז X מעל התמיסה, Pa; Kr(X) - קבוע הנרי עבור גז X, mol×l1 × Pa1 . הקבוע של הנרי תלוי באופי הגז, הממס והטמפרטורה. חוק הנרי תקף רק לתמיסות מדוללות יחסית, בלחצים נמוכים ובהיעדר אינטראקציה כימית בין מולקולות הגז המומס והממס. חוק הנרי הוא מקרה מיוחד של החוק הכללי של דלטון. אם אנחנו מדברים על פירוק לא של חומר גזי אחד, אלא של תערובת של גזים, אז המסיסות של כל רכיב מצייתת לחוק דלטון: המסיסות של כל רכיב של תערובת גז בטמפרטורה קבועה היא פרופורציונלית ללחץ החלקי של הרכיב מעל הנוזל ואינה תלויה בלחץ הכולל של התערובת ובאינדיבידואליות של שאר הרכיבים. במילים אחרות, במקרה של המסת תערובת של גזים בנוזל, הלחץ החלקי p מוחלף לביטוי המתמטי של חוק הנרי! של רכיב זה. הלחץ החלקי של רכיב מובן כחלק של לחץ הרכיב מהלחץ הכולל של תערובת הגז: Рi/ רמְשׁוּתָף הלחץ החלקי של רכיב מחושב באמצעות הנוסחה בחקר מסיסות גזים בנוזלים בנוכחות אלקטרוליטים, קבע הרופא והפיזיולוגי הרוסי I.M. Sechenov (1829-1905) את התבנית הבאה (חוק סצ'נוב): מסיסות הגזים בנוזלים בנוכחות אלקטרוליטים פוחתת; משתחררים גזים. Рi = Pמְשׁוּתָף ×(Xi) איפה עi - לחץ חלקי של רכיב Xi; Рמְשׁוּתָף הלחץ הכולל של תערובת הגז; x(Xi) הוא חלק השומה של הרכיב i-th. בחקר מסיסות גזים בנוזלים בנוכחות אלקטרוליטים, קבע הרופא והפיזיולוגי הרוסי I.M. Sechenov (1829-1905) את הדפוס הבא (חוק סצ'נוב): מסיסות הגזים בנוזלים בנוכחות אלקטרוליטים פוחתת; משתחררים גזים. 16. תפקיד הדיפוזיה בתהליכי העברת חומרים במערכות ביולוגיות דיפוזיה ממלאת תפקיד חשוב במערכות ביולוגיות. קודם כל, התנועה של חומרים מזינים ומוצרים מטבוליים בנוזלי רקמות מתרחשת באמצעות דיפוזיה. בנוסף, במקרים רבים, קצב התהליכים הפיזיקוכימיים באורגניזמים חיים נקבע על פי קצב הדיפוזיה של מגיבים, שכן דיפוזיה של ריאגנטים, ככלל, היא השלב האיטי ביותר בתהליך, בעוד שתגובות ביוכימיות בהשתתפות של ריאגנטים. אנזימים ממשיכים מהר מאוד. כל תא חי מוקף בממברנה, המשמשת להגנה ולוויסות הסביבה התוך-תאית. חומרים עוברים דרך ממברנות בשני מנגנונים עיקריים: על ידי דיפוזיה רגילה (הובלה פסיבית) והובלה המופעלת אנרגטית (הובלה אקטיבית). השכבה הפנימית של הממברנה מורכבת משרשראות פחמימנים. לכן, הרבה מולקולות ניטרליות קטנות ומולקולות NMC לא קוטביות מסיסות בשכבה זו ויכולות לעבור דרך הממברנה על ידי דיפוזיה רגילה לאורך שיפוע ריכוז. הובלה זו של חומרים נקראת פסיבית. הדיפוזיה ממלאת תפקיד גדול בתהליך החמצן של הדם בריאות. בשל ההסתעפות הגדולה, פני השטח של alveoli של הריאות גדולים (~ 80 מ"ר), ולכן חמצן מתמוסס באופן פעיל בפלסמה וחודר לתאי הדם האדומים. דם ורידי מדולדל מחמצן - ריכוז החמצן בדם ורידי שואף לאפס. כתוצאה מכך, שיפוע ריכוז החמצן בין האטמוספרה לדם הנכנס לריאות הוא גבוה, מה שמוביל לספיגה אקטיבית (לפי חוק פיק). העברה של חומרים מאזור בריכוז נמוך יותר לאזור בריכוז גבוה יותר כנגד שיפוע נקראת הובלה פעילה. תהליך כזה אינו יכול להתרחש באופן ספונטני ודורש הוצאת אנרגיה. מקור האנרגיה הוא תגובה אקסטרגונית של הידרוליזה של תרכובת ביו-אי-אורגנית - אדנוזין טריפוספט (ATP). התפלגות יציבה במצב יציב של ריכוזי יוני K בתוך התא ומחוצה לו מושגת כאשר זרימת יוני K דרך הממברנה לתוך התא הופכת שווה לזרימת יוני K מהתא, הנובעת מדיפוזיה פסיבית. התפלגות (הומאוסטזיס יונים) מושגת באופן דומה עבור יוני Na, רק הובלה אקטיבית ודיפוזיה פסיבית מפצה של יונים מכוונת מול הזרימות המקבילות של יוני K. תהליך הדיפוזיה נמצא בשימוש נרחב ברפואה. לדוגמה, שיטת דיאליזה המבוססת על סלקטיביות של דיפוזיה של חומרים נמוכים מולקולריים דרך קרום חדיר למחצה לאורך שיפוע ריכוז משמשת בפרקטיקה הקלינית ליצירת מכשיר "כליה מלאכותית". חלקיקי IUD אינם עוברים דרך קרום חדיר למחצה, ולכן ניתן לטהר נוזלים ביולוגיים (לדוגמה, פלזמה דם) על ידי דיאליזה מחומרים מזיקים נמוכים מולקולריים - "סיגים" (אוריאה, חומצת שתן, בילירובין, אמינים, עודפי יוני K. ) המצטברים במחלות שונות. במהלך הטיהור, הדם של המטופל, המנוזל מוריד, נכנס לחדרים מיוחדים עם ממברנות חדירות למחצה שדרכן ניתן להתפזר NMS ולהוציאו מהפלזמה. במספר מחלות דלקתיות מתרחשת הרס של חלבונים, ובפלסמת הדם, יחד עם NMS, ישנם שברי חלבון (פפטידים ופוליפפטידים) שגם אותם יש להסיר. 17. הורדת נקודת הקפאה והעלאת נקודת הרתיחה של תמיסות תוצאה ישירה של ירידה בלחץ האדים מעל התמיסה היא שינוי בטמפרטורת ההקפאה ΔTз וטמפרטורות רתיחה של תמיסות ΔTк בהשוואה לערכי הכמויות הללו עבור ממס טהור. הקשרים בין הכמויות הללו נובעים גם מהחוק השני של התרמודינמיקה. נקודת הרתיחה של נוזל היא הטמפרטורה שבה לחץ האדים שלו הופך שווה ללחץ החיצוני (לדוגמה, ב-101,3 kPa, נקודת הרתיחה של המים היא 100 מעלות צלזיוס). טמפרטורת ההקפאה (התגבשות) של נוזל היא הטמפרטורה שבה לחץ האדים מעל הנוזל שווה ללחץ האדים מעל הפאזה המוצקה. אם נציין את טמפרטורות ההקפאה והרתיחה של התמיסה כ-T3 ו-Tk, ואותם ערכים עבור הממס כמו T°3 ו-T°к , אז נקבל: ΔTk = Tк - T°к > 0, ΔT3 = T°3 - ט3 > 0. את ההשפעות של הגדלת נקודת הרתיחה והפחתת נקודת הקיפאון של תמיסות ניתן להסביר בצורה איכותית באמצעות העיקרון של Le Chatelier. ואכן, אם במערכת "נוזל - אדים" בשיווי משקל (לדוגמה, H2О(ו) - ח2О(ז)), להכניס חומר מסיס לא נדיף, ואז לחץ האדים של הממס מעל התמיסה יקטן. כדי לפצות על הירידה בלחץ האדים ולהשיג את מצב שיווי המשקל הקודם, יש לחמם את התמיסה לטמפרטורה גבוהה יותר (יותר מ-373°K), מכיוון שהתהליך הוא אנדותרמי. שתהיה מערכת שיווי משקל "שלב מוצק - נוזל", למשל H2О(ט) > נ2О(ו), ב-273°K. אם כמות מסוימת של חומר לא נדיף (בלתי מסיס בפאזה המוצקה) מומסת בשלב הנוזל, אזי ריכוז מולקולות המים בפאזה הנוזלית יקטן. בהתאם לעיקרון של Le Chatelier, יתחיל תהליך שמגביר את כמות המים בשלב הנוזל - הפשרת הקרח. כדי ליצור שיווי משקל חדש, יש לקרר את התמיסה, כלומר להוריד את הטמפרטורה, מכיוון שהתהליך הוא אקסותרמי. לפי חוק ראול לתמיסות מדוללות, הירידה בלחץ האדים היא פרופורציונלית לריכוז התמיסה. כתוצאה מכך, העלייה בנקודת הרתיחה והירידה בנקודת הקיפאון של תמיסות כאלה אמורות לעלות עם הגדלת הריכוז שלהן. תוך כדי לימוד הקפאה והרתחה של תמיסות, ראולט קבע: עלייה בנקודת הרתיחה ΔTк וירידה בטמפרטורת הקפאה ΔТ3 תמיסות מדוללות של לא אלקטרוליטים עומדות ביחס ישר לריכוז המולרי של התמיסה: ΔTк =Kэb(איקס), ΔT3 = קз b(איקס), איפה ב(X) - ריכוז מולארי, מול/ק"ג; Кз וקэ - מקדמי מידתיות, ק"ג × K × מול1 , אשר נקראים קבועים אבוליומטריים וקבועים קריומטריים, בהתאמה. המשמעות הפיזית של הקבועים קэ וקз מתברר אם נקבל את ב(X) = 1. ואז קэ = ΔTк , וקз = ΔTз . במילים אחרות, הקבוע האבוליומטרי שווה מספרית לעלייה בנקודת הרתיחה של תמיסה אחת מולרית, והקבוע הקריומטרי שווה לירידת טמפרטורת ההקפאה של תמיסה אחת מולרית. קבועים אבוליומטריים וקריומטריים תלויים רק באופי הממס ואינם תלויים באופי המומס (פתרונות אידיאליים). 18. לחץ אוסמוטי אוסמוזה היא חדירת בעיקר חד-כיוונית של מולקולות ממס (דיפוזיה) דרך קרום חדיר למחצה מממס לתמיסה או מתמיסה עם ריכוז נמוך יותר לתמיסה עם ריכוז גבוה יותר. תנאי הכרחי להתרחשות אוסמוזה הוא נוכחות של ממס ותמיסה או שתי תמיסות בריכוזים שונים, מופרדים על ידי קרום חדיר למחצה. מנקודת המבט של התרמודינמיקה, הכוח המניע של האוסמוזה הוא הרצון של המערכת להשוות ריכוזים, שכן במקרה זה האנטרופיה של המערכת גדלה, מכיוון שהמערכת עוברת למצב פחות מסודר, אנרגיית הגיבס של המערכת יורד בהתאם, והפוטנציאלים הכימיים משתווים. לכן, אוסמוזה היא תהליך ספונטני. ניסוי פשוט יכול לשמש כהמחשה המסבירה את הקשר בין מנגנון האוסמוזה לשינויים בלחץ האדים מעל התמיסה. אם שמים בכלי זכוכית סגור כוס עם ממס טהור וכוס עם תמיסה של חומר לא נדיף כלשהו (רמות הנוזלים בכלים זהות), אז לאחר זמן מה רמת הנוזל בראשון הזכוכית תרד, ורמת התמיסה בכוס השנייה תגדל. במקרה זה, הממס עובר מהכוס הראשונה לכוס השנייה, וזה נובע (לפי חוק ראולט) מלחץ האדים הנמוך יותר של הממס מעל התמיסה מאשר מעל הממס הטהור. לפיכך, חלל האוויר בין הממס לתמיסה פועל כממברנה חדירה למחצה. ממלאים כלי עם דפנות חדירה למחצה בתמיסה מימית של גלוקוז ומניחים אותו בכלי אחר במים כך שרמות הנוזלים בכלים אלו תואמות. כתוצאה מאוסמוזה, נפח התמיסה בכלי הראשון גדל ורמת הנוזל בכלי זה עולה בהדרגה. זה יוצר לחץ הידרוסטטי נוסף המונע אוסמוזה. הלחץ ההידרוסטטי של עמודת הנוזל בשיווי משקל אוסמוטי קובע את הלחץ האוסמוטי של התמיסה. לחץ אוסמוטי הוא ערך הנמדד בלחץ ההידראולי המינימלי שיש להפעיל על תמיסה כדי שהאוסמוזה תיפסק. חוקי הלחץ האוסמוטי. ואן הוף הציע משוואה אמפירית לחישוב הלחץ האוסמוטי של תמיסות מדוללות של לא אלקטרוליטים: π = C(איקס)rt, כאשר π - לחץ אוסמוטי, kPa; С(איקס) - ריכוז מולארי, מול/ליטר; R הוא קבוע הגז האוניברסלי, שווה ל 8,31 kPa - l/(מול - K); T - טמפרטורה מוחלטת, K. למרות שחוק ואן הוף נקבע על בסיס נתונים ניסיוניים, ניתן לגזור אותו מתנאי שיווי המשקל התרמודינמי ב-ΔG = 0. לכן, יש להתייחס לחוק זה כפועל יוצא של החוק השני של התרמודינמיקה. הביטוי בצורה שלעיל דומה למשוואת קלפיירון-מנדלייב עבור גזים אידיאליים, אך משוואות אלו מתארות תהליכים שונים. 19. תפקיד האוסמוזה והלחץ האוסמוטי במערכות ביולוגיות תופעת האוסמוזה ממלאת תפקיד חשוב במערכות כימיות וביולוגיות רבות. הודות לאוסמוזה, זרימת המים לתאים ולמבנים בין-תאיים מווסתת. גמישות התאים (טורגור), המבטיחה את גמישות הרקמות ושימור צורה מסוימת של איברים, נובעת מלחץ אוסמוטי. לתאי בעלי חיים וצמחים יש ממברנות או שכבת פני השטח של פרוטופלזמה בעלות תכונות של ממברנות חדירה למחצה. כאשר תאים אלה ממוקמים בתמיסות בריכוזים שונים, מתרחשת אוסמוזה. פתרונות בעלי אותו לחץ אוסמוטי נקראים איזוטוניים. אם לשתי תמיסות יש לחצים אוסמוטיים שונים, אז התמיסה עם לחץ אוסמוטי גבוה יותר היא היפרטונית ביחס לשני, והשנייה היפוטונית ביחס לראשון. כאשר שמים תאים בתמיסה איזוטונית, הם שומרים על גודלם ותפקודם רגיל. כאשר שמים תאים בתמיסה היפוטונית, מים מתמיסה חיצונית פחות מרוכזת עוברים לתוך התאים, מה שמוביל להתנפחות שלהם, ולאחר מכן לקרע של הממברנות ולדליפה של תוכן התא. הרס זה של תאים נקרא תמוגה; במקרה של תאי דם אדומים, תהליך זה נקרא המוליזה. דם עם תוכן תאי המשתחרר במהלך המוליזה נקרא דם לכה בשל צבעו. כאשר שמים תאים בתמיסה היפרטונית, מים מהתאים יוצאים לתמיסה מרוכזת יותר, והתאים מתכווצים (מתייבשים). תופעה זו נקראת פלסמוליזה. נוזלים ביולוגיים אנושיים (דם, לימפה, נוזלי רקמה) הם תמיסות מימיות של תרכובות במשקל מולקולרי נמוך - NaCl, KCl, CaCl, תרכובות במשקל מולקולרי גבוה - חלבונים, פוליסכרידים, חומצות גרעין ואלמנטים נוצרים - אריתרוציטים, לויקוציטים, טסיות דם. ההשפעה הכוללת שלהם קובעת את הלחץ האוסמוטי של נוזלים ביולוגיים. הלחץ האוסמוטי של דם אנושי ב-310°K (37°C) הוא 780 kPa (7,7 atm). אותו לחץ נוצר על ידי תמיסה מימית של 0,9% של NaCl (0,15 מול/ליטר), אשר, לפיכך, היא איזוטונית עם דם (תמיסת מלח). עם זאת, בנוסף ליוני Na ו-C1, ישנם יונים נוספים בדם, כמו גם BMC ואלמנטים שנוצרו. לכן, למטרות רפואיות, נכון יותר להשתמש בתמיסות המכילות את אותם רכיבים ובאותן כמויות לאלו הכלולות בדם. תמיסות אלו משמשות כתחליף דם בניתוח. גוף האדם, בנוסף ללחץ האוסמוטי, מאופיין בקביעות (הומאוסטזיס) של פרמטרים פיזיים וכימיים אחרים של דם, כמו חומציות. תנודות מותרות בלחץ האוסמוטי בדם אינן משמעותיות מאוד ואפילו בפתולוגיה חמורה אינן עולות על כמה עשרות kPa. במהלך הליכים שונים, ניתן להזריק רק תמיסות איזוטוניות לדם של בני אדם ובעלי חיים בכמויות גדולות. במקרה של איבוד דם גדול (לדוגמה, לאחר ניתוחים קשים, פציעות), נותנים לחולים מספר ליטרים של תמיסה איזוטונית כדי לפצות על אובדן הנוזלים בדם. תופעת האוסמוזה נמצאת בשימוש נרחב בפרקטיקה הרפואית. לפיכך, בניתוח משתמשים בחבישות היפרטוניות (גזה ספוגה בתמיסת היפרטונית 10% NaCl), המוחדרות לפצעים מוגלתיים. על פי חוק האוסמוזה, זרימת נוזל הפצע דרך הגזה מופנית כלפי חוץ, וכתוצאה מכך הפצע מתנקה כל הזמן מוגלה, מיקרואורגניזמים ומוצרי ריקבון. 20. דרגת דיסוציאציה (יינון). כוח אלקטרוליט אלקטרוליטים שמתפרקים כמעט לחלוטין ליונים (מיוננים) נקראים חזקים, ואלקטרוליטים שאינם מייננים לחלוטין נקראים חלשים. בתמיסה של אלקטרוליטים חלשים, יחד עם יונים, יש מולקולות לא מיוננות. דווקא על ידי יינון לא שלם הסביר ס' ארניוס מדוע המקדם האיזוטוני של תמיסות של אלקטרוליטים חלשים אינו שווה למספר שלם. כדי לאפיין כמותית את שלמות הדיסוציאציה, הוצג מושג מידת הדיסוציאציה (יינון). דרגת הניתוק (יינון) של אלקטרוליט היא היחס בין מספר המולקולות שהתפרקו ליונים לבין המספר הכולל של המולקולות שלו המוכנסות לתמיסה. במילים אחרות, an הוא החלק של מולקולות אלקטרוליטים שהתפרקו ליונים. דרגת הדיסוציאציה של אחד מבוטאת כאחוז או חלק מיחידה: αн = Nн/ Np, כאשר N הוא מספר מולקולות האלקטרוליטים שהתפרקו ליונים; Np מספר מולקולות האלקטרוליט המוכנס לתמיסה (מומס). כן, עבור C(CHXNUMXCOOH) = 0,1 מול/ליטר, דרגת ניתוק αн = 0,013 (או 1,3%). בהתבסס על מידת הדיסוציאציה, האלקטרוליטים מחולקים באופן קונבנציונלי לחזקים (αн > 30%) וחלש (αн < 3%. בין לבין, אלקטרוליטים נחשבים לחוזק בינוני. כמעט כל המלחים נחשבים לאלקטרוליטים חזקים. מבין החומצות והבסיסים החשובים ביותר, אלה כוללים H2SO4 , HCI, НВг, HI, HNO3 , NaOH, KOH, Ba(OH)2 . רוב החומצות האורגניות, כמו גם כמה תרכובות אנאורגניות, שייכות לאלקטרוליטים חלשים - H2S, HCN, N2עם3 , כך3 , HCl0, N2או, נ3VO3 ,Hg2CI2 ,Fe(SCN)3 . An נקבע בניסוי על ידי מדידת הסטייה של תכונות הקולקטיביות של תמיסות אלקטרוליטים מהתלות התיאורטית עבור פתרונות אידיאליים. לדוגמא, מקדם האיזוטוני i נקבע בשיטה הקריוסקופית, לאחר מכן מחשבים את מידת הניתוק, עבור אלקטרוליטים חזקים ניכרת מידת הניתוק, שכן הם מתפרקים ליונים כמעט לחלוטין. הסטייה של המקדם האיזוטוני i מהידע של מספרים שלמים מוסברת עבורם לא על ידי נוכחות של מולקולות לא קשורות בתמיסה, אלא על ידי סיבות אחרות. הדיסוציאציה מלווה בשחרור או בספיגה של חום. לכן, מידת הדיסוציאציה צריכה להיות תלויה בטמפרטורה. ניתן להעריך את השפעת הטמפרטורה באמצעות העיקרון של Le Chatelier. אם הדיסק אלקטרוליטי מתרחש עם ספיגת החום, אז עם עליית הטמפרטורה עולה, אם עם שחרור החום, יורד. מידת הניתוק האלקטרוליטי מושפעת מריכוז התמיסה. כאשר התמיסה מדוללת, מידת הדיסוציאציה עולה באופן משמעותי. בהקשר זה, הסיווג המצוין של חוזק האלקטרוליטים לפי מידת הדיסוציאציה αн תקף רק לתמיסות בריכוז של כ-0,1 מול/ליטר. אם ניקח בחשבון את הדיסוציאציה האלקטרוליטית כתהליך הפיך בשיווי המשקל, אזי, בהתאם לעיקרון של Le Chatelier, דילול עם מים מגדיל את מספר המולקולות המפורקות, כלומר, מידת ההתנתקות עולה. מידת הניתוק של אלקטרוליטים חלשים מושפעת גם מהוספת יונים באותו השם. לפיכך, הכנסת אלקטרוליט חלש למערכת שיווי המשקל מגדילה את ריכוז היונים, אשר, בהתאם לעיקרון של Le Chatelier, מובילה לשינוי משמעותי בשיווי המשקל הדיסוציאציה שמאלה, כלומר, ירידה במידת הדיסוציאציה. לפיכך, הוספת יונים באותו שם לתמיסה של אלקטרוליט חלש מפחיתה את מידת הניתוק שלו. 21. קבוע דיסוציאציה. חוק הרבייה של אוסטוולד. תיאוריה של פתרונות אלקטרוליטים חזקים ניתן לאפיין ניתוק אלקטרוליטי כתהליך הפיך בשיווי משקל כמותית על ידי קבוע הניתוק (היוניזציה) שנקבע על ידי חוק הפעולה ההמונית. חוק הפעולה ההמונית, למהדרין, חל על תגובות הפיכות, כלומר על פתרונות של אלקטרוליטים חלשים. לדוגמה, ניתן לייצג את הדיסוציאציה של האלקטרוליט KtnAnm כתהליך שיווי משקל: Ktn Anm × nKtm+ +mAn . על פי חוק הפעולה ההמונית, קבוע שיווי המשקל כתוב כך: КД = (Ktm+)n+(אנn)m + (KtnAnm) איפה (Ktm+) וn ) - ריכוזי שיווי משקל מולרי של יוני אלקטרוליטים; (קטnAnm) הוא ריכוז שיווי המשקל המולארי של מולקולות אלקטרוליטים לא מפורקות; КД - קבוע שיווי משקל, הנקרא קבוע דיסוציאציה. משוואה זו תקפה רק עבור תמיסות מדוללות של אלקטרוליטים חלשים. כאשר מיישמים אותו על תמיסות מרוכזות ועל תמיסות של אלקטרוליטים חזקים, יש לשנות את המשוואה. ככל שקבוע הדיסוציאציה K גדול יותרД , ככל שהאלקטרוליט מתנתק יותר. בניגוד למידת הדיסוציאציה קД תלוי רק באופי הממס, האלקטרוליט והטמפרטורה, אך אינו תלוי בריכוז התמיסה. לפיכך, גם הקבוע וגם מידת הדיסוציאציה האלקטרוליטית הם מאפיינים כמותיים של דיסוציאציה. מטבע הדברים, יש קשר ביניהם. חומצות רב-בסיסיות ובסיסי רב-חומצים מתנתקים בשלבים. לדוגמה, ההתנתקות של חומצה זרחתית מתרחשת בשלושה שלבים:  באופן דומה עבור בסיסי חומצה (לדוגמה, Ca(OH)2) - דיסוציאציה מתרחשת בשני שלבים. פירוק צעד מאופיין בעובדה שהפירוק של האלקטרוליט בכל שלב עוקב מתרחש במידה פחותה מאשר בקודם. אופי זה של השינוי בקבועי הדיסוציאציה יכול להיות מוסבר על ידי משיכה אלקטרוסטטית המבוססת על חוק קולומב. אנרגיית היינון היא מינימלית כאשר יון מנותק ממולקולת אלקטרוליט ניטראלית. ניתוק יון בכל שלב ניתוק עוקב מצריך הגדלת אנרגיה, שכן סילוק היון מתרחש מחלקיק שהמטען שלו גדל בשלבים הבאים. ההתנתקות הכמעט מוחלטת של אלקטרוליטים חזקים ליונים, ללא קשר לריכוז התמיסות שלהם, מאושרת על ידי שיטות מחקר פיזיקליות ופיזיקוכימיות. לפיכך, ערכי חום הנטרול של כל החומצות החזקות על ידי בסיסים חזקים בתמיסות מדוללות כמעט זהים. ללא קשר לאופי החומצה והבסיס, מתקבל אותו ערך AH = 56,5 קילו ג'ל/מול. עובדה זו היא עדות ברורה לניתוק מוחלט של תמיסות מדוללות של חומצות ובסיסים. בכל המקרים, התהליך השכיח המתרחש במהלך הנטרול הוא שילוב של יונים בשומה 22. תורת החומצות והבסיסים אלקטרוליטים רבים, במיוחד הידרוקסידים של יסודות שונים, מציגים תכונות של חומצות או בסיסים. ניתוק של EON הידרוקסיד יכול להתרחש בשני סוגים: 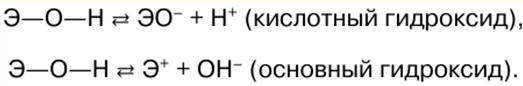 הפסקה יכולה להתרחש בשני הקשרים הקבוצתיים נֵצַח. כידוע, הקוטביות והחוזק של קשרים תלויים בהבדל באלקטרושליליות של יסודות, בגודל ובמטען היעיל של האטומים. אם אנרגיית שבירת הקשר O-H פחותה משמעותית מהאנרגיה של שבירת הקשר E-O, אזי ההתנתקות של ההידרוקסיד מתנהלת לפי הסוג החומצי. אם, להיפך, אנרגיית שבירת הקשר O-H גדולה משמעותית מאנרגיית שבירת הקשר E-O, הרי שהדיסוציאציה מתנהלת לפי הסוג העיקרי. בהידרוקסידים של מתכות אלקליות ואדמה אלקליין, כמו גם במתכות מעבר במצבי חמצון נמוכים, חוזק הקשר E-O נמוך יחסית, חמצן קשור חזק יותר למימן, וההתנתקות של E-O-H מתרחשת בעיקר לפי הסוג הבסיסי, כלומר עם חיסול של הידרוקסידיון. זה נובע מהעובדה שליונים של יסודות כאלה יש גדלים גדולים למדי ומטען יעיל קטן, כלומר יש להם יכולת קיטוב חלשה. עם עלייה בדרגת החמצון, ההשפעה המקטבת של אטום E גדלה (הגדלת המטען הספציפי), חמצן נקשר בצורה חזקה יותר ליסוד E, וההתנתקות של E-O-H מתרחשת בעיקר לפי סוג החומצה, כלומר יון מימן. מתפצל. זה האחרון קשור לחלוקה מחדש של צפיפות האלקטרונים באטום החמצן. כתוצאה מכך, הקשר E-O מתחזק וקשר O-H נחלש. נכון לעכשיו, אין הגדרה חד משמעית למושגים של חומצה ובסיס, שיכולים לשמש באותה מידה לאפיון אינטראקציות חומצה-בסיס בכל ממס. כדי לאפיין אלקטרוליטים רבים בתמיסות מימיות, עדיין ניתן להשתמש במושגים של חומצה ובסיס שניתנו על ידי Arrhenius: 1) חומצה היא אלקטרוליט המתנתק בתמיסות ליצירת יוני מימן H; 2) בסיס הוא אלקטרוליט המתנתק בתמיסות ליצירת הידרוקסידיונים OH; 3) אמפוליט (אמפוטרי הידרוקסיד) הוא אלקטרוליט המתנתק בתמיסה ליצירת יוני מימן ויוני הידרוקסיד. אמפוליטים כוללים הידרוקסידים של אבץ, אלומיניום, כרום ואלמנטים אמפוטריים אחרים, כמו גם חומצות אמינו, חלבונים וחומצות גרעין. יישום העיקרון של Le Chatelier על שרשרת של שיווי משקל חומצה-בסיס מראה שעם עלייה בריכוז ההידרוקסידיונים OH במערכת, עולה ההסתברות להתנתקות מסוג חומצה. עלייה בריכוז יוני המימן H+ במערכת מביאה לניתוק מועדף לפי הסוג העיקרי. משמעות הדבר היא שבסביבה חומצית האמפוליט מפגין אופי בסיסי, ובסביבה בסיסית הוא מפגין אופי חומצי. לדוגמה, הידרוקסיד אבץ מתנהג כמו בסיס בעת אינטראקציה עם חומצות: Zn (OH)2 + 2HCI - ZnCI2 + 2H2הו ובעת אינטראקציה עם אלקליות - כחומצה: Zn(OH)2+ 2NaOH → Na2[Zn(OH)4]. 23. מערכות חיץ דם. פלזמת דם למערכות חוצץ יש חשיבות רבה בשמירה על איזון חומצה-בסיס של אורגניזמים. נוזלים תוך-תאיים וחוץ-תאיים של כל היצורים החיים מאופיינים בערך pH קבוע, הנשמר באמצעות מערכות חיץ. ערך ה-pH של רוב הנוזלים התוך-תאיים הוא בטווח שבין 6,8 ל-7,8. מאזן החומצה-בסיס ה-CO בדם האדם מובטח על ידי מערכות חיץ מימן פחמתי, פוספט וחלבון. ערך ה-pH התקין של פלזמה בדם הוא 7,40 ± 0 05. זה מתאים לטווח ערכי החומציות הפעילה בין 3,7 ל-4,0x108 מול/ליטר. מכיוון שישנם אלקטרוליטים שונים בדם (HC03 , ח2CO3 , ח2RO4 , NRO42 ), חלבונים, חומצות אמינו, זה אומר שהם מתנתקים עד כדי כך שהפעילות של a(H+) נמצאת בטווח שצוין. בשל העובדה שתכולת החומרים האנאורגניים והאורגניים בפלזמה ובתאי הדם אינה זהה, רצוי לשקול בנפרד את מרכיבי הדם הללו. פלזמת דם מערכת חיץ מימן פחמתי HCO3 / נ2עם3 מורכב מחומצה פחמנית H2עם3 והבסיס המצומד NSO3 . זוהי מערכת החיץ החשובה ביותר של הדם. אחד המרכיבים הוא חומצה פחמית H2עם3 - נוצר על ידי אינטראקציה של CO מומס בפלזמה2 עם מים: עם2(ר) + H2הוא נ2עם3. שבו CO2(ר) - ריכוז של CO מומס2 . קבוע שיווי המשקל לתגובה זו הוא: K = [N2עם3] / [שיתוף2] בין CO2 ב-alveoli ובחץ מימן קרבונט בפלסמת הדם הזורמת דרך נימי הריאות, נוצרת שרשרת של שיווי משקל. מערכת חיץ מימן קרבונט פועלת כפתרון חיץ פיזיולוגי יעיל ליד pH7,4. כאשר חומצות - תורמות H - נכנסות לדם+ שיווי המשקל בשרשרת לפי העיקרון של לה שאטלייר עובר שמאלה כתוצאה מכך שיוני HCO3 קושרים יוני H למולקולות H2עם3 . במקרה זה, הריכוז של H2עם3 עולה, וריכוז יוני HCO3 הולך למטה. הגדלת ריכוז H2עם3 מוביל לשינוי שיווי משקל שמאלה (העיקרון של Le Chatelier). זה גורם להתפוררות של H2עם3 ועלייה בריכוז CO2 , מומס בפלזמה. כתוצאה מכך, שיווי המשקל עובר שמאלה ולחץ ה-CO עולה.2 בתוך הריאות. עודף CO2 מופרש מהגוף. כתוצאה מכך, מערכת המימן הפחמתי בדם מגיעה במהירות לשיווי משקל עם CO2 ב-alveoli ומבטיח ביעילות שמירה על pH קבוע של פלזמת הדם. 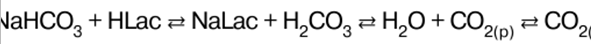 לפיכך, ערך pH תקין בדם נשמר עם שינוי pH קל הנגרם על ידי חמצת. בחללים סגורים, אנשים חווים לעתים קרובות חנק (חוסר חמצן) ונשימה מוגברת. עם זאת, חנק קשור לא כל כך עם חוסר חמצן כמו עם עודף של CO2. עודף CO2 באטמוספירה על פי חוק הנרי מוביל לפירוק נוסף של CO2 בדם. וזה מוביל לירידה ב-pH בדם, כלומר לחמצת. מערכת חיץ המימן קרבונט מגיבה במהירות הגבוהה ביותר לשינויים ב-pH בדם. קיבולת חיץ החומצה שלו היא Bк = 40 ממול/ליטר של פלזמה בדם, וקיבולת החיץ של אלקלי קטנה בהרבה ושווה לערך Bщ = 1-2 ממול/ליטר פלזמת דם. 24. תגובות ניטרול תגובות ניטרול הן תגובות חליפין בין חומצות לבסיסים, הגורמות להיווצרות מלח ומים. בואו נסתכל על הסוגים השונים של תגובות נטרול. 1. נטרול בסיס חזק עם חומצה חזקה: KOH + HNO3 -נו3 + H2O. המשוואה היונית המולקולרית לתגובה כזו היא H+ +הו → ח2O וערך שלילי של אנרגיית Gibbs ΔG° מצביעים על כך ששיווי המשקל כמעט מוסט לעבר היווצרות מים. מקרה שכיח של תגובת נטרול הוא אינטראקציה של חומצות ובסיסים הנבדלים בחוזקם (דרגת הדיסוציאציה). תגובות אלו אינן מגיעות להשלמה עקב תגובה הפוכה של הידרוליזה של מלח. 2. נטרול חומצה חלשה בעלת בסיס חזק:  או בצורה של יונים מולקולריים:  במקרה זה, תגובת הנטרול הפיכה. התגובה של נטרול של בסיס חלש עם חומצה חזקה היא גם הפיכה:  או בצורה של יונים מולקולריים: 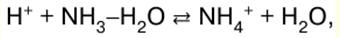 וגם - בסיס חלש עם חומצה חלשה: 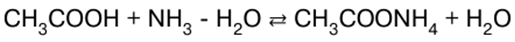 או בצורה של יונים מולקולריים:  במערכות אלו, שיווי המשקל מוסט מאוד ימינה, שכן מים הם אלקטרוליט חלש בהרבה מחומצה הידרוציאנית, אמוניה וחומצה אצטית. תגובות ניטרול הן הבסיס לשיטת הנטרול. שיטה זו משמשת במעבדות קליניות כדי לקבוע את החומציות של מיץ הקיבה ואת קיבולת החיץ של פלזמת הדם. בפרמקולוגיה, הוא משמש לניתוח כמותי של חומצות אנאורגניות (הידרוכלוריות, גופריתיות, בוריות) וחומצות אורגניות (אצטית, בנזואית, טרטרית, לימון, סליצילית). במחקרים ביו-פרמצבטיים, ה-pKa של חומצות ו-pKa של בסיסים נקבעים בשיטת הנטרול, שכן ניתן להשתמש בערכם של ערכים אלה כדי לחזות את יכולתן של תרופות לעבור דרך ממברנות ביולוגיות. טיטרציה של חומצה-בסיס משמשת לקביעת pKа חומצות אמינו ו-pKа קבוצות מתנתקות הכלולות בחלבונים. מעקומות טיטרציה של חלבון המתקבלות בשתי טמפרטורות שונות, ניתן לקבוע את מספר הקבוצות הקרבוקסיל, האימידאזול ושאר הקבוצות. טיטרציה של חומצות אמינו וחלבונים מאפשרת לקבוע את הנקודות האיזואלקטריות שלהן. הידרוליזה מתייחסת לתגובת הפירוק של חומר עם מים. תרכובות כימיות ממחלקות שונות יכולות לעבור הידרוליזה: חלבונים, שומנים, פחמימות, אתרים, מלחים וכו'. בכימיה אנאורגנית נתקלים לרוב בהידרוליזה של מלחים. 25. הידרוליזה של מלח הידרוליזה של מלח - זוהי האינטראקציה של מלח עם מולקולות מים, המובילה ליצירת תרכובות מפורקות מעט. תהליך ההידרוליזה כולל העברה של פרוטון ממולקולת מים ליון נתון (CO32 + HOH * HCO3+ הוא ) או מיון נתון, לרבות קטיון מתכת hydrated, למולקולת מים. בהתאם לאופי המלח, מים פועלים כחומצה או כבסיס, ומלח הוא בסיס מצומד או חומצה מצומדת, בהתאמה. ישנן ארבע אפשרויות הידרוליזה אפשריות בהתאם לסוג המלח. 1. מלחים הנוצרים מחומצה חזקה ובסיס חלש:  2. מלחים הנוצרים מבסיס חזק וחומצה חלשה: CH3COONa + HON → CH3COOH + NaOH. 3. מלחים הנוצרים מחומצה חלשה ובסיס חלש. אמוניום ציאניד עובר הידרוליזה לפי התגובה: 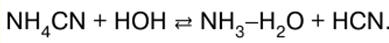 4. מלחים הנוצרים מחומצה חזקה ובסיס חזק. NaCl, KNO3 אינם נתונים להידרוליזה. המנגנון של הידרוליזה של מלח הוא אינטראקציית הקיטוב של יוני מלח עם מעטפת ההידרציה שלהם. ככל שהאינטראקציה הזו חזקה יותר, כך ההידרוליזה מתרחשת יותר אינטנסיבית. כל המקרים הנחשבים של הידרוליזה נגעו למלחים שנוצרו על ידי בסיסים חד-חומצים וחומצות חד-בסיסיות. מלחים של חומצות רב-בסיסיות ובסיסים רב-חומציים עוברים הידרוליזה שלבים ויוצרים מלחים חומציים ובסיסיים. מבחינה כמותית, הידרוליזה כשיווי משקל CO מאופיינת במידת ההידרוליזה וקבוע ההידרוליזה. מידת ההידרוליזה נמדדת לפי היחס בין כמות החומר שעבר הידרוליזה לכמות הכוללת של המומס. מידת ההידרוליזה תלויה באופי המלח, בריכוזו ובטמפרטורה שלו. על פי חוק הפעולה המונית, מידת ההידרוליזה עולה עם דילול התמיסה. אז עם ריכוז Na2CO3 0,001 מול/ליטר מידת ההידרוליזה היא 34%. במקרה הכללי, החוקים הבאים מתקיימים. 1. הידרוליזה של המלח צריכה לעלות עם עליית הטמפרטורה ודילול התמיסה. 2. בהידרוליזה הפיכה, בהתאם לעיקרון של Le Chatelier, יש לדכא את התהליך על ידי החמצה (אם מלח זה נוצר מחומצה חזקה ובסיס חלש, מצטברים יוני H) או על ידי אלקליזציה (אם המלח נוצר על ידי א. חומצה חלשה ובסיס חזק, מצטברים יוני OH). 3. הידרוליזה של מלחים, הגורמת להיווצרות של מוצרים מסיסים או גזיים גרועים המורחקים מכדור התגובה (עקרון הסטת שיווי המשקל), היא בלתי הפיכה. לדוגמה, הידרוליזה של Pb(SO4)2 ממשיך לחלוטין בשל היווצרות משקע PbO2: Pb(SO4)2 + 2H2O → PbO2 + 2H2SO4. הידרוליזה אופיינית לקבוצות רבות של תרכובות אנאורגניות ואורגניות. הידרוליזה של תרכובות אנאורגניות חשובה להערכת רעילותן. הידרוליזה של תרכובות אורגניות משמשת להשגת מוצרים יקרי ערך מעץ, שומנים, אתרים ודברים אחרים, אך להידרוליזה תפקיד חשוב במיוחד בחייהם של אורגניזמים חיים. 26. תגובת משקעים ופירוק תגובות החלפה המתרחשות בתמיסות אלקטרוליט כוללות תגובות משקעים ופירוק. תגובות משקעים מלוות במשקעים. תגובות המלוות בהמסה של משקעים נקראות תגובות פירוק. מערכות המורכבות ממשקע של אלקטרוליט מסיס בקושי ותמיסה רוויה מעליו נמצאות בשימוש נרחב. במערכות כאלה נוצר שיווי משקל דינמי בין התמיסה הרוויה למשקע. עקב מסיסות נמוכה, ריכוז האלקטרוליט המסיס בקושי בתמיסה קטן מאוד, ולכן ניתן להניח שהוא מתפרק לחלוטין בתמיסה. במילים אחרות, נוצר שיווי משקל דינמי בתמיסה רוויה בין השלב המוצק של החומר לבין היונים שעברו לתמיסה. לדוגמה, בתמיסה רוויה של AgCl מתרחש שיווי המשקל: AgCl(T) → Ag+(P) + קל(R). ריכוז הפאזה המוצקה AgCl כערך קבוע אינו נכלל בביטוי עבור קבוע שיווי המשקל. כתוצאה מכך, קבוע שיווי המשקל נקבע רק על ידי תוצר של ריכוזי יונים בתמיסה והוא נקרא קבוע מסיסות או תוצר. במקרה הכללי, עבור אלקטרוליט Ktn Anm קבוע המסיסות נקבע על ידי התוצר הסטוכיומטרי של ריכוזי יונים: Кпр= [Ktm+ ]n[אנn]m ערך זה מאפיין את מסיסות האלקטרוליט בטמפרטורה קבועה בהיעדר חומרים זרים. קבוע קпр אין פירושו ריכוזים קבועים של יונים בודדים בתמיסה. לפיכך, ניתן להגדיל את ריכוז יוני Ag בתמיסת AgCl רוויה על ידי הוספת, למשל, AgNO3 , במקרה זה, שיווי המשקל על פי העיקרון של Le Chatelier יעבור שמאלה, מה שיוביל לעלייה בקצב שקיעת היונים. לאחר זמן מה, שיעורי פירוק AgCl והמשקעים של יוני Ag ו-Cl יהיו שווים. שיווי המשקל החדש שנקבע יתאפיין, כבעבר, בערך של Kпр(AgCl), אך ריכוזי שיווי המשקל של יוני Ag ו-Cl ישתנו. אז על סמך קпр ניתן לחזות היווצרות ופירוק משקעי אלקטרוליטים על סמך שני כללים. 1. אלקטרוליט משקע כאשר התוצר הסטוכיומטרי של ריכוזי היונים שלו בתמיסה גדול מקובוע המסיסות. 2. משקע האלקטרוליט מתמוסס כאשר התוצר הסטוכיומטרי של ריכוזי היונים המרכיבים אותו בתמיסה הופך פחות מקובוע המסיסות. תגובות משקעים הן הבסיס לשיטת המשקעים, המשמשת בניתוח כמותי של תרופות. שיטת המשקעים משמשת בניתוח קליני של כלורידים בשתן, מיץ קיבה, דם, ובפרקטיקה סניטרית והיגיינית - בניתוח מי שתייה. מדענים מאמינים כי למסיסות השונה של תרכובות טבעיות של יסודות במים הייתה השפעה רבה על התוכן שלהם באורגניזמים חיים. קיים קשר הדוק בין מסיסות תרכובות במים להשפעה הרעילה של יונים של מספר יסודות. למשל, הצגת אל3 + לתוך הגוף עקב היווצרות של אלומיניום פוספט מסיס גרוע AlPO4 27. תגובות חיזור אחד המושגים הבסיסיים של כימיה אנאורגנית הוא מושג מצב החמצון (CO). מצב החמצון של יסוד בתרכובת הוא המטען הצורני של אטום היסוד, מחושב מתוך הנחה שאלקטרוני ערכיות מועברים לאטומים בעלי אלקטרושליליות יחסית גבוהה יותר (REO) וכל הקשרים במולקולת המתחם הם יוניים. מצב החמצון של היסוד E מצוין בחלק העליון של סמל היסוד בסימן "+" או "-" לפני המספר. מצב החמצון של יונים הקיימים בפועל בתמיסה או בגבישים עולה בקנה אחד עם מספר המטען שלהם ומסומן באופן דומה עם סימן "+" או "-" אחרי המספר, למשל Cl,Ca2+. שיטת ה-Stock משמשת גם לציון מצב החמצון בספרות רומיות אחרי סמל היסוד: Mn (VII), Fe (III). שאלת הסימן למצב החמצון של אטומים במולקולה נפתרת על סמך השוואה של האלקטרושליליות של האטומים המחוברים ביניהם היוצרים את המולקולה. במקרה זה, לאטום בעל אלקטרושליליות נמוכה יותר יש מצב חמצון חיובי, ולאטום בעל אלקטרושליליות גבוהה יותר יש מצב חמצון שלילי. יש לציין שלא ניתן לזהות את מצב החמצון עם הערכיות של יסוד. ערכיות, המוגדרת כמספר הקשרים הכימיים שבאמצעותם אטום נתון מחובר לאטומים אחרים, אינה יכולה להיות שווה לאפס ואין לה סימן "+" או "-". למצב החמצון יכול להיות גם ערך חיובי ושלילי, והוא יכול גם לקבל ערך אפס או אפילו חלקי. אז במולקולת CO2 מצב החמצון של C הוא +4, ובמולקולת CH4 מצב החמצון של C הוא 4. הערכיות של carbon4a בשתי התרכובות היא IV. למרות החסרונות לעיל, השימוש במושג מצב חמצון נוח בעת סיווג תרכובות כימיות וניסוח משוואות לתגובות חיזור. כאשר יסוד מתחמצן, מצב החמצון עולה, במילים אחרות, הגורם המפחית במהלך התגובה מגביר את מצב החמצון. להיפך, כאשר אלמנט מצטמצם, מצב החמצון יורד, כלומר, במהלך התגובה, חומר החמצון מפחית את מצב החמצון. לפיכך, אנו יכולים לתת את הניסוח הבא של תגובות חיזור: תגובות חיזור הן תגובות המתרחשות עם שינוי במצב החמצון של האטומים של היסודות המרכיבים את החומרים המגיבים. 28. חומרי חמצון וחומרים מפחיתים כדי לחזות מוצרים ואת הכיוון של תגובות חיזור, כדאי לזכור שחומרי חמצון טיפוסיים הם חומרים פשוטים שלאטומים שלהם יש REO גדול > 3,0 (יסודות מקבוצות VIA ו-VIIA). מתוכם, חומרי החמצון החזקים ביותר הם פלואור (OEO = 4,0), חמצן (OEO = 3,0) וכלור (OEO = 3,5). חומרי חמצון חשובים כוללים PbO2 , KMnO4 , Ca(SO4)2 , ל2Cr2O7 , HClO, HClO3, KSIO4, NaBiO3, ח2SO4(קונצרן), H.N.O.3(קונצרן) , Na2O2 , (NH4)2S2O8 , KSIO3 , ח2O2 וחומרים אחרים המכילים אטומים בעלי COXNUMX גבוה או גבוה יותר. חומרים מפחיתים אופייניים כוללים חומרים פשוטים שלאטומים שלהם יש REO קטן < 1,5 (מתכות מקבוצות IA ו-IIA ועוד כמה מתכות). חומרים מצמצמים חשובים כוללים את H2ש, נ.ה.3, HI, KI, SnCl2 , FeSO4 ,C,H2 ,CO,H2SO3 , cr2(כן4)3 , CuCl, Na2S2O3 וחומרים אחרים המכילים אטומי CO נמוכים. חומרים המכילים אטומים במצב חמצון מקסימלי ומינימלי יכולים, בהתאמה, להיות רק חומרי חמצון, למשל K.2SG2O7 , KMpo4 , PbO2 , HClO4 או רק חומרים מפחיתים, למשל NH3 , ח2ש, היי. חומרים המכילים אטומים במצבי חמצון בינוניים מסוגלים גם להגביר וגם להקטין את מצב החמצון, כלומר הם יכולים להיות גם חומרים מצמצמים (בפעולת חומר מחמצן פעיל יותר מהם) וגם חומרים מחמצנים (בפעולה של חומר פעיל יותר). מהם). , חומר מפחית). חומרים כאלה מפגינים דואליות חיזור. כאשר מרכיבים משוואות לתגובות חיזור, ניתן להשתמש בשתי שיטות: שיטת איזון האלקטרונים ושיטת יוני-אלקטרונית (שיטת חצי תגובה). רעיון נכון יותר של תהליכי חיזור בפתרונות מסופק על ידי השיטה היונים האלקטרונית. בשיטה זו מנבאים שינויים שקיימים בפועל בתמיסה על ידי יונים ומולקולות. בנוסף לניבוי תוצרי תגובה, משוואות חצי תגובה יוניות נחוצות להבנת תהליכי החיזור המתרחשים במהלך אלקטרוליזה ובתאים גלווניים. שיטה זו משקפת את תפקידה של הסביבה כמשתתפת בתהליך. ולבסוף, כאשר משתמשים בשיטה זו, אין צורך לדעת מראש את כל החומרים הנוצרים, שכן רבים מהם מתקבלים על ידי ניסוח משוואת תגובות החיזור. יש לזכור שלמרות שחצי תגובות משקפות את התהליכים האמיתיים המתרחשים במהלך תגובות חיזור, לא ניתן לזהות אותן עם השלבים האמיתיים (מנגנון) של תגובות חיזור. האופי והכיוון של תגובות החיזור מושפעים מגורמים רבים: אופי המגיבים, תגובת המדיום, ריכוז, טמפרטורה, זרזים. יש לזכור כי ערך שלילי לא תמיד מוביל להחלטה חד משמעית לגבי מהלך התגובה בפועל בכיוון נתון, שכן יש צורך בנוסף לקחת בחשבון את הגורם הקינטי. 29. משמעות ביולוגית של תהליכי חיזור תגובות חיזור הן תהליכים כימיים המלווים בהעברת אלקטרונים ממולקולה או יונים אחת לאחרות. במהלך תגובות חיזור מתרחשים שני תהליכים הקשורים זה בזה: חמצון והפחתה. חמצון הוא תהליך של איבוד אלקטרונים. צמצום הוא תהליך של הוספת אלקטרונים. חומרים שהאטומים או היונים שלהם תורמים אלקטרונים נקראים חומרים מפחיתים. חומרים שהאטומים או היונים שלהם מחברים אלקטרונים (או מושכים זוג אלקטרונים משותף) נקראים סוכני חמצון. בתגובה של אבץ עם CuSO4 Cu2 + הוסף אלקטרונים: סי2+ + 2ה- - סי0 . אטומי אבץ תורמים אלקטרונים: Zn0 -Zn2 + 2ה-. בהתאם לכך, CuSO4 - חומר מחמצן, Zn - חומר מפחית. תהליכים חשובים באורגניזמים של בעלי חיים הם תגובות של חמצון אנזימטי של חומרי מצע: פחמימות, שומנים, חומצות אמינו. כתוצאה מתהליכים אלה, אורגניזמים מקבלים כמויות גדולות של אנרגיה. כ-90% מכל דרישת האנרגיה של זכר בוגר מסופקת על ידי האנרגיה המופקת ברקמות על ידי חמצון של פחמימות ושומנים. שאר האנרגיה - ~10% - מגיעה מפירוק חמצוני של חומצות אמינו. חמצון ביולוגי מתרחש באמצעות מנגנונים מורכבים בהשתתפות מספר רב של אנזימים. במיטוכונדריה, חמצון מתרחש כתוצאה מהעברת אלקטרונים ממצעים אורגניים. כנשאי אלקטרונים, שרשרת הנשימה המיטוכונדריאלית כוללת חלבונים שונים המכילים קבוצות פונקציונליות שונות שנועדו להעביר אלקטרונים. כאשר הם נעים לאורך השרשרת מאמצעי ביניים אחד לאחר, אלקטרונים מאבדים אנרגיה חופשית. על כל זוג אלקטרונים המועבר דרך שרשרת הנשימה לחמצן, מסונתזות 3 מולקולות ATP. האנרגיה החופשית המשתחררת כאשר 2 אלקטרונים מועברים לחמצן היא 220 קילו ג'ל/מול. הסינתזה של מולקולת ATP אחת בתנאים סטנדרטיים דורשת 1 קילו-ג'יי. מכאן ברור שחלק משמעותי למדי מהאנרגיה החופשית המשתחררת במהלך העברת זוג אלקטרונים אחד מאוחסן במולקולות ATP. מנתונים אלה, מתברר התפקיד של העברת אלקטרונים רב-שלבית מהחומר המפחית הראשוני לחמצן. האנרגיה הגדולה (30,5 קילו-ג'יי) המשתחררת במהלך העברת זוג אלקטרונים אחד לחמצן מחולקת למספר חלקים המתאימים לשלבים בודדים של חמצון. בשלושה שלבים כאלה, כמות האנרגיה המשתחררת תואמת בערך את האנרגיה הדרושה לסינתזה של מולקולת ATP 220. תגובות חיזור הן הבסיס לשיטות אוקסידמטריה, המשמשות באנליזה קלינית לקביעת יוני Ca, חומצת שתן, אנזימים קטלאז ופרוקסידאז, סוכר בדם, ובניתוח סניטרי והיגייני - לקביעת יכולת החמצון של מים, תכולת כלור פעיל באקונומיקה, שאריות כלור במי שתייה ביתיים.מים 30. קשר כימי ומאפייני הניסוי שלו פיתוח מודל אטומי מודרני וחיזוי תכונותיהם של אטומים בודדים על בסיסו הוא הישג חשוב מאוד של מכניקת הקוונטים. עם זאת, אטומים מבודדים נמצאים רק לעתים רחוקות בתנאים ארציים. גופי הטבע הדומם והחי המקיפים אותנו מורכבים ממגוון של מולקולות. א.מ. בוטלרוב (1828-1886) יצר את התיאוריה של המבנה הכימי של חומרים אורגניים (1861). מזמן זה ואילך, המושגים "ערכיות" ו"קשר כימי" החלו להיכנס בהדרגה לכימיה. ערכיות היא היכולת של אטום לחבר מספר מסוים של אטומים אחרים ליצירת מולקולה. ערכיות מסומנת באמצעות מקפים ליד סמל האלמנט. מימן (H) הוא חד ערכי, חמצן (0=) הוא דו ערכי. מספר פסי הערכיות קובע את מספר הקשרים הכימיים שאטום נתון יכול ליצור עם אטומים אחרים. קשר כימי הוא קבוצה של אינטראקציות בין אלקטרונים וגרעינים המובילות לחיבור של אטומים למולקולה. תכונות הקשרים הכימיים נחקרות בשיטות שונות. בשיטות כימיות נקבע מספר הקשרים האטומיים (הערך) והתגובתיות שלהם. באמצעות שיטות פיזיקליות נקבעים אורך, חוזק, כיוון וקוטביות של קשרים כימיים. אורך הקשר הכימי gс היא כמות הנמדדת לפי המרחק בין גרעיני האטומים המחוברים. כיחידת מדידה לאורכו של קשר כימי, gс נוח לשימוש פיקומטר (pm): 1:10 = XNUMX12 מ ' חוזק קשר כימי Eс - ערך נמדד על ידי אנטלפיה ΔEс חינוך לתקשורת. כיחידת מדידה לחוזק של קשר כימי, Eс נעשה שימוש ב-kJ/mol. אוריינטציה של קשר כימי אс - ערך הנמדד בזווית בין כיווני הקשרים של אטום נתון עם אטומים שכנים של המולקולה. הזווית ac נקראת זווית הקשר. יחידת מדידה של זווית קשר אс - תואר. קוטביות קשר כימי μс - כמות הנמדדת במומנט החשמלי של חיבור נתון. המומנט החשמלי של שני מטענים חשמליים +q ו-q, שווה בערכם המוחלט ומנוגד בסימן, שווה ל-μ = qr, כאשר r הוא המרחק בין המטענים. שני המטענים הללו יוצרים דיפול חשמלי. קשר כימי מקוטב כאשר 2 אטומים בעלי אלקטרושליליות שונה (EOE) מתחברים. כתוצאה מכך, מטען שלילי עודף δ מופיע על אטום בעל ערך OEO גדול, ועודף מטען חיובי +δ מופיע על אטום אחר בעל ערך OEO נמוך יותר. הקוטביות של החיבור מחושבת באמצעות הנוסחה: μс = δrс. נוח להשתמש ביחידת Debye הלא מערכתית (D) כיחידה למדידת הקוטביות של קשר כימי - 1 D = 3,3 x 1030 C/m. הקוטביות של הקשר O-H במולקולת מים היא μהוא = 1,5 ד'. המחקר של קשרים כימיים הראה שברוב המקרים לאורכם, החוזק, הכיוון והקוטביות של אותו קשר כימי בתרכובות שונות יש בערך אותם ערכים. מכאן נובע שהאינטראקציות המובילות ליצירת קשר נתון בין אטומים הן מאותו אופי במולקולות שונות. תיאוריות מכניות קוונטיות של קשר כימי מספקות הסבר לעובדה זו. 31. קשר מימן. קשר מימן בין מולקולרי ותוך מולקולרי קשרים כימיים במולקולות הם בדרך כלל חזקים מאוד, האנרגיה שלהם היא בטווח של 100-150 קילו ג'ל/מול. בנוסף, ישנם קשרי מימן כביכול, שעוצמתם היא 10-40 קילו-ג'יי/מול. אורכם של איגרות חוב אלו הוא 270-230 בהתאמה. קשר מימן בין אטומיםА ו-EВ נקראת האינטראקציה המתבצעת על ידי אטום מימן המחובר ל-EА או EВ קשר כימי. התמונה של קשר מימן במקרה הכללי נראית כך: ЭА-נ...הв.. ברור שקשר המימן הוא תלת-מרכזי, שכן 3 אטומים לוקחים חלק ביצירתו. כדי שקשר כזה יתרחש, יש צורך שהאטומים של EА ו-EВ בעל אלקטרושליליות גבוהה. אלו הם אטומים של היסודות השליליים ביותר: חנקן (OEO = 3,0), חמצן (OEO = 3,5), פלואור (OEO = 4,0) וכלור (OEO = 3,0). קשר מימן נוצר כתוצאה מהשילוב של מימן ls-AO ושני אטומי 2pAO EА ו-EВ; 2 אורביטלים מכוונים לאורך קו ישר אחד. לכן, קשר המימן הוא ליניארי. קשר מימן נקרא: 1) תוך מולקולרי, אם האטומים של EА ו-EВ , המחוברים בקשר זה, שייכים לאותה מולקולה; 2) אינטרמולקולרי, אם האטומים של EА ו-EВ נמצאים במולקולות שונות. קשרי מימן תוך-מולקולריים ממלאים תפקיד ביולוגי חיוני, שכן הם קובעים, למשל, את המבנה הסליל של מולקולות חלבון פולימרי. בחלבונים, אלו הם קשרי N-H...O בין שיירי חומצות אמינו. קשרי מימן בין מולקולריים חשובים לא פחות. בעזרתם מתחברים שרשראות של חומצות גרעין ליצירת סליל כפול. ישנם שני סוגים של קשרים בין בסיסי גרעין - NHN ו-N-H-O. האנרגיה הקינטית הממוצעת של תנועה תרמית של מולקולות היא בסדר גודל של 3/2RT. בטמפרטורת גוף אנושית של 37°C (310°K) זה בערך 4 קילו ג'ל/מול. חוזקם של קשרי מימן הוא בטווח של 10-40 קילו ג'ל/מול, כך שהם חזקים מספיק כדי לעמוד בפני השפעות קבועות של מולקולות שמסביב ולהבטיח את קביעות הצורה של מבנים ביולוגיים פולימריים. במקביל, כאשר מולקולות פעילות פוגעות, קשרי מימן נשברים מעת לעת, ואז משוחזרים שוב, מה שמבטיח את התרחשותם של תהליכי חיים שונים. הדוגמאות הנחשבות ממחישות בבירור את מגוון היישומים הרחב יותר של שיטת MO LCAO מאשר שיטת BC. עם זאת, ניתן להשתמש בהצלחה בשיטת BC כדי לחזות את התכונות והמבנה של חומרים רבים, כולל תרכובות מורכבות. 32. מאקרו ומיקרו-אלמנטים בסביבה ובגוף האדם ישנם סיווגים שונים של יסודות כימיים הכלולים בגוף האדם. לפיכך, V.I. Vernadsky, בהתאם לתכולה הממוצעת (שבריר מסה w,%) באורגניזמים חיים, חילק אלמנטים לפי מערכת עשרת הימים. על פי סיווג זה, אלמנטים הכלולים באורגניזמים חיים מחולקים לשלוש קבוצות: מאקרו, מיקרו ואולטרה-מיקרואלמנטים. מקרונוטרינטים אלו אלמנטים שתכולתם בגוף גבוהה מ-102%. אלה כוללים חמצן, פחמן, מימן, חנקן, זרחן, גופרית, סידן, מגנזיום, נתרן וכלור. יסודות קורט אלו אלמנטים שתכולתם בגוף נע בין 103 ל105%. אלה כוללים יוד, נחושת, ארסן, פלואור, ברום, סטרונציום, בריום וקובלט. Ultramicroelements אלו אלמנטים שהתוכן שלהם בגוף נמוך מ-105%. אלה כוללים כספית, זהב, אורניום, תוריום, רדיום וכו'. נכון לעכשיו, אולטרה-מיקרו-אלמנטים משולבים עם מיקרו-אלמנטים לקבוצה אחת. סיווג זה משקף רק את התוכן של יסודות באורגניזמים חיים, אך אינו מצביע על התפקיד הביולוגי והמשמעות הפיזיולוגית של יסוד מסוים. V.V. Kovalsky, בהתבסס על משמעותם לחיים, חילק יסודות כימיים לשלוש קבוצות. אלמנטים חיוניים (בלתי ניתנים להחלפה). הם כל הזמן כלולים בגוף האדם ומהווים חלק מאנזימים, הורמונים וויטמינים: H, O, Ca, N, K, P, Na, S, Mg, d, C, I, Mn, Cu, Co, Fe, Zn, Mo, V. המחסור שלהם מוביל לשיבוש חיי אדם נורמליים. יסודות טומאה אלמנטים אלה כלולים כל הזמן בגוף של בעלי חיים ובני אדם: Ga, Sb, Sr, Br, F, B, Be, Li, Si, Sn, Cs, Al, Ba, Ge, As, Rb, Pb, Ra, Bi, Cd, Cr, Ni, Ti, Ag, Th, Hg, U, Se. תפקידם הביולוגי אינו מובן או לא ידוע. יסודות טומאה Sc, Tl, In, La, Pr, Sm, W, Re, Tb וכו'. נמצא בגוף של בני אדם ובעלי חיים. נתוני הכמות והתפקיד הביולוגי טרם התבררו. היסודות הדרושים לבנייה ולתפקוד של תאים ואורגניזמים שונים נקראים אלמנטים ביוגנים. נכון לעכשיו, עדיין לא ניתן לפרט במדויק את כל היסודות הביוגנים בשל הקושי לקבוע ריכוזים נמוכים מאוד של מיקרו-אלמנטים ולבסס את תפקידיהם הביולוגיים. עבור 24 יסודות, הביוגניות הוקמה בצורה מהימנה. אלו הם מרכיבים של הראשון וכמה מרכיבים של הקבוצה השנייה (לפי קובלסקי). 33. טופוגרפיה של היסודות הביוגניים החשובים ביותר בגוף האדם איברים אנושיים מרכזים יסודות כימיים שונים בדרכים שונות, כלומר מיקרו-אלמנטים ומקרו-אלמנטים מפוזרים בצורה לא אחידה בין איברים ורקמות שונות. רוב המיקרו-אלמנטים מצטברים בכבד, בעצמות וברקמת השריר. רקמות אלו הן המאגרים העיקריים (מאגרים) עבור מיקרו-אלמנטים רבים. אלמנטים עשויים להפגין זיקה ספציפית לאיברים מסוימים ולהיכלל בהם בריכוז גבוה. ידוע כי אבץ מרוכז בלבלב, יוד - בבלוטת התריס, פלואור - באמייל השן, אלומיניום, ארסן, ונדיום מצטברים בשיער ובציפורניים, קדמיום, כספית, מוליבדן - בכליות, בדיל - במעי. רקמות, סטרונציום - בבלוטת הערמונית, רקמת עצם, בריום - ברשתית הפיגמנט, ברום, מנגן, כרום - בבלוטת יותרת המוח וכו'. באורגניזמים, מיקרו-אלמנטים יכולים להיות במצב קשור ובצורה של צורות יוניות חופשיות. ידוע שסיליקון, אלומיניום, נחושת וטיטניום ברקמת המוח הם בצורת קומפלקסים עם חלבונים, בעוד מנגן הוא בצורה יונית. מימן וחמצן הם מאקרו-אלמנטים. הם חלק ממים, המכילים בממוצע כ-65% בגוף האדם הבוגר. המים מפוזרים בצורה לא אחידה ברחבי האיברים, הרקמות והנוזלים הביולוגיים של האדם. לפיכך, במיץ קיבה, רוק, פלזמת דם, לימפה, מים מהווים בין 89,5 ל-90%, בשתן, בחומר האפור של המוח, בכליות - 80%, בחומר הלבן של המוח, הכבד, העור, חוט השדרה , שרירים, ריאות, לב - 70-80%. הכמות הנמוכה ביותר של מים - 40% - נמצאת בשלד. מאקרו-אלמנטים - פחמן, מימן, חמצן, חנקן, גופרית, זרחן - הם חלק מחלבונים, חומצות גרעין ותרכובות אחרות פעילות ביולוגית של הגוף. תכולת הפחמן בחלבונים היא 51-55%, חמצן - 22-24%, חנקן - 15-18%, מימן - 6,5-7%, גופרית - 0,3-2,5%, זרחן - כ-0,5%. פחמן, מימן וחמצן כלולים גם הם בהרכב הפחמימות, שתכולתם ברקמות החיות קטנה - כ-2%. אלמנטים אלה הם חלק משומנים (שומנים). בנוסף, פוספוליפידים מכילים זרחן בצורה של קבוצות פוספט. השומנים מתרכזים במידה רבה ביותר במוח (12%), לאחר מכן בכבד (5%), בחלב (2-3%) ובנסיוב הדם (0,6%). עם זאת, עיקר הזרחן (600 גרם) כלול ברקמת העצם. זה מהווה 85% מהמסה של כל הזרחן המצוי בגוף האדם. הזרחן מרוכז גם ברקמות הקשות של השיניים, בהן הוא כלול יחד עם סידן, כלור, פלואור בצורת הידרוקסיל, כלור, פלואורפטיטים בנוסחה הכללית Ca5 (PO4)3X, כאשר X = OH, CI, F בהתאמה. הסידן מרוכז בעיקר בעצם וגם ברקמות השיניים. נתרן וכלור נמצאים בעיקר בנוזלים תאיים, ואילו אשלגן ומגנזיום נמצאים בעיקר בנוזלים תוך תאיים. בצורה של פלואורידים, נתרן ואשלגן הם חלק מהעצם ורקמות השיניים. מגנזיום כ-Mg פוספט3 (פו4)2 הכלולים ברקמות הקשות של השן. הורמונים מעורבים בשמירה על תוכן מסוים של מאקרו ומיקרו-אלמנטים בגוף. 34. תפקיד ביולוגי של יסודות כימיים בגוף התפקיד הביולוגי של יסודות כימיים בגוף האדם מגוון ביותר. התפקיד העיקרי של מאקרו-אלמנטים הוא לבנות רקמות, לשמור על לחץ אוסמוטי קבוע, הרכב יוני וחומצה-בסיס. מיקרו-אלמנטים, בהיותם חלק מאנזימים, הורמונים, ויטמינים, חומרים פעילים ביולוגית כמרכיבים מורכבים או מפעילים, מעורבים בחילוף החומרים, תהליכי רבייה, נשימת רקמות וניטרול חומרים רעילים. מיקרו-אלמנטים משפיעים באופן פעיל על התהליכים של hematopoiesis, חמצון, הפחתה, חדירות של כלי דם ורקמות. מאקרו ומיקרו-אלמנטים - סידן, זרחן, פלואור, יוד, אלומיניום, סיליקון - קובעים את היווצרות העצם ורקמות השיניים. זוהו מחלות רבות הקשורות למחסור או הצטברות עודפת של מיקרו-אלמנטים שונים. מחסור בפלואור גורם לעששת דנטלית, מחסור ביוד גורם לזפק אנדמי, ועודף מוליבדן גורם לגאוט אנדמי. דפוסים מסוג זה קשורים לעובדה שגוף האדם שומר על איזון של ריכוזים אופטימליים של יסודות ביוגנים - הומאוסטזיס כימי. הפרעה באיזון זה עקב מחסור או עודף של האלמנט עלולה להוביל למחלות שונות. בנוסף לששת המקרו-אלמנטים העיקריים - אורגנוגנים (פחמן, מימן, חנקן, חמצן, גופרית וזרחן), המרכיבים פחמימות, שומנים, חלבונים וחומצות גרעין, יסודות מאקרו אנאורגניים נחוצים לתזונה תקינה של בני אדם ובעלי חיים - סידן, כלור , מגנזיום, אשלגן, נתרן - ויסודות קורט - נחושת, פלואור, יוד, ברזל, מוליבדן, אבץ, וגם, אולי (מוכח לבעלי חיים), סלניום, ארסן, כרום, ניקל, סיליקון, בדיל, ונדיום. ניתוח של התוכן והיחס של מיקרו-אלמנטים בגוף האדם משמש גם ברפואה משפטית. לדוגמה, במקרה של הרעלת אלכוהול, בהשפעת אלכוהול אתילי, תכולת הסידן בכבד עולה, והנתרן והאשלגן יורדים. יחד עם זאת, בלב ובכליות, להיפך, תכולת הסידן יורדת. מחסור באלמנטים כמו ברזל, נחושת, פלואור, אבץ, יוד, סידן, זרחן, מגנזיום ועוד כמה בתזונה מוביל להשלכות חמורות על בריאות האדם. עם זאת, יש לזכור כי לא רק מחסור, אלא גם עודף של חומרים מזינים מזיק לגוף, שכן הומאוסטזיס כימי מופרע. רכיבים מינרלים, החיוניים בכמויות זניחות, הופכים לרעילים בריכוזים גבוהים יותר. מספר יסודות (כסף, כספית, עופרת, קדמיום וכו') נחשבים רעילים, שכן כניסתם לגוף, אפילו בכמויות קורט, מובילה לתופעות פתולוגיות קשות. אלמנטים שונים ותרכובותיהם נמצאים בשימוש נרחב כתרופות. לפיכך, לימוד התפקיד הביולוגי של יסודות כימיים, הבהרת הקשר בין חילוף החומרים של יסודות אלה לחומרים פעילים ביולוגית אחרים (אנזימים, הורמונים, ויטמינים) תורם ליצירת תרופות חדשות ולפיתוח משטרי מינון אופטימליים הן לטיפול והן למניעתי. מטרות. 35. יסודות S ותרכובותיהם מים הם אחת מתרכובות המימן החשובות והנפוצות ביותר על פני כדור הארץ. שטח המים תופס כמעט 75% משטח כדור הארץ. גופו של מבוגר מכיל בממוצע 65-67% מים, עובר (4 חודשים) - 94%, ויילוד - 74%. כל התגובות הכימיות בגוף מתרחשות רק בסביבה מימית. חיים ללא מים בלתי אפשריים. מים מזוקקים הם תרופה פרמקופיאלית. תרכובת מימן נוספת משמשת בפרקטיקה הרפואית - מי חמצן H2. תרכובת זו היא תוצר לוואי מטבולי חשוב. מי חמצן הוא נוזל חסר צבע ושקוף. במגע עם העור והריריות, הוא גורם לתחושת צריבה. מולקולה H2О2 קוֹטבִי. נוכחותם של זוגות בודדים של אלקטרונים על אטומי חמצן מאפשרת ליצור קשרים תורם-מקבל של מי חמצן עם ליגנדים - קולטי אלקטרונים. מצב חמצון של חמצן ב-H2О2 שווה ל-1, כלומר יש לו ערך ביניים בין מצב החמצון של חמצן במים (2) ובחמצן יסודי O2 . מכאן נובע שמי חמצן יכול להפגין הן תכונות של חומר מחמצן והן תכונות של חומר מפחית (דואליות חיזור). עם זאת, אם לשפוט לפי פוטנציאל החיזור הסטנדרטי של חצי תגובות, מי חמצן מאופיין יותר בתכונות חמצון. מי חמצן טהור אינו יציב מבחינה תרמודינמית ובעמידה הוא מתפרק בצורה נפיצה למים ולחמצן, ומשחרר כמות גדולה של חום. תמיסות מימיות של מי חמצן יציבות יותר; במקום קריר ניתן לאחסן אותן לאורך זמן. מי חמצן נמכר בדרך כלל בצורה של תמיסה מימית 30% - פרהידרול. תהליך הפירוק המשותף של מי חמצן מואץ משמעותית בנוכחות מלחי מתכות כבדות. פירוק מי חמצן באמצעות יון מתכתי של מי חמצן עלול להוביל ליצירת רדיקלים, שהחשובים שבהם הם הידרוקסיד HO והידרופרוקסיד. הרעילות נובעת מהעובדה ש-H2О2 ולגבי2 אינטראקציה עם שכבת השומנים של קרומי התא ופוגעת בהם. בפרקטיקה הרפואית, מי חמצן משמש בעיקר כחומר קוטל חיידקים חיצוני. פעולה ח2О2 מבוסס על יכולת החמצון של מי חמצן וחוסר המזיק של תוצר ההפחתה שלו - מים. בעת טיפול בפצעים, החמצן המשתחרר ממלא תפקיד כפול: 1) יש אפקט אנטי-מיקרוביאלי, מפיג ריח ופיגמנטציה, הורג גופים מיקרוביאליים; 2) יוצר קצף, מקדם את המעבר של חלקיקי ריקבון רקמות להשעיה וניקוי פצעים. תמיסה מימית של 3% מי חמצן משמשת כתרופה פרמקופיאלית, ותמיסת מי חמצן של 6% משמשת להלבנת שיער. בצורת תמיסה של 30%, מי חמצן משמש לטיפול בצורת היבלות של חזזית ולסילוק יבלות נעורים. 36. תפקיד ביולוגי של יסודות s של קבוצה IA (ליתיום, רובידיום, צסיום, פרנסיום) מבחינת התוכן בגוף האדם, נתרן (0,08%) ואשלגן (0,23%) הם מאקרו-אלמנטים, והמתכות האלקליות הנותרות הן ליתיום (104%), רובידיום (105%), צסיום (104%) - למיקרו-אלמנטים. ליתיום תכולת הליתיום בגוף האדם היא כ-70 מ"ג (10 ממול) - 104%. תרכובות ליתיום בבעלי חיים גבוהים יותר מתרכזות בכבד, בכליות, בטחול, בריאות, בדם ובחלב. הכמות המקסימלית של ליתיום נמצאת בשרירי האדם. תפקידו הביולוגי של ליתיום כיסוד קורט טרם הובהר במלואו. הוכח שברמת ממברנות התא, יוני Li (בריכוז מספיק) מתחרים עם יוני נתרן כאשר הם חודרים לתאים. ברור שהחלפת יוני Na בתאים ביוני Li קשורה לקוולנטיות רבה יותר של תרכובות ליתיום, וכתוצאה מכך הן מסיסות טוב יותר בפוספוליפידים. הוכח כי לחלק מתרכובות הליתיום יש השפעה חיובית על חולים עם מאניה דיפרסיה. נספגים ממערכת העיכול, יוני Li מצטברים בדם. כאשר ריכוז יוני ה-Li מגיע ל-0,6 ממול/ליטר ומעלה, חלה ירידה במתח הרגשי והיחלשות של עוררות מאנית. יחד עם זאת, יש לשלוט בקפדנות על התוכן של יוני Li בפלזמה בדם. במקרים בהם ריכוז יוני ה-Li עולה על 1,6 ממול/ליטר, יתכנו תופעות שליליות. רובידיום וצסיום על פי התוכן של רובידיום בגוף האדם (105%) וצסיום (104אחוזים שייכים למיקרו-אלמנטים. הם כל הזמן כלולים בגוף, אך תפקידם הביולוגי טרם הובהר. בהיותו אנלוגי מלא של אשלגן, רובידיום מצטבר גם בנוזל התוך תאי ויכול להחליף כמות שווה של אשלגן בתהליכים שונים. איזוטופ רדיואקטיבי 13rCs ו 87Rb משמש בהקרנות של גידולים ממאירים, כמו גם בחקר חילוף החומרים של אשלגן. בשל התמוטטותם המהירה, ניתן אפילו להחדיר אותם לגוף ללא חשש מהשפעות מזיקות ארוכות טווח. צָרְפַת זהו יסוד כימי רדיואקטיבי המתקבל באופן מלאכותי. ישנן עדויות לכך שפרנציום מסוגל להצטבר באופן סלקטיבי בגידולים בשלבים המוקדמים ביותר של התפתחותם. תצפיות אלו עשויות להיות שימושיות באבחון סרטן. לפיכך, מבין מרכיבי הקבוצה IA, Li, Rb, Cs פעילים מבחינה פיזיולוגית, ו-Na ו-K חיוניים. הדמיון בין המאפיינים הפיזיקליים-כימיים של Li ו-Na, בשל הדמיון של המבנה האלקטרוני של האטומים שלהם, מתבטא גם בפעולה הביולוגית של קטיונים (הצטברות בנוזל החוץ-תאי, ניתנות להחלפה). אופי דומה של הפעולה הביולוגית של קטיונים של אלמנטים של תקופות ארוכות - ק+,רב+, Cs+ (הצטברות בנוזל תוך תאי, ניתנות להחלפה) נובעת גם מהדמיון של המבנה האלקטרוני והתכונות הפיזיקוכימיות שלהם. זהו הבסיס לשימוש בתכשירי נתרן ואשלגן להרעלת מלחי ליתיום ורובידיום. 37. תפקיד ביולוגי של יסודות s של קבוצה IA (נתרן, אשלגן) תכולת הנתרן בגוף האדם השוקל 70 ק"ג היא כ-60 גרם (2610 ממול) - 0,08%. מתוך כמות זו, 44% מהנתרן נמצא בנוזל החוץ-תאי ו-9% בנוזל התוך-תאי. כמות הנתרן הנותרת נמצאת ברקמת העצם, שהיא האתר של שקיעת יוני Na בגוף. כ-40% מהנתרן הכלול ברקמת העצם מעורב בתהליכים מטבוליים, ובזכות זה השלד הוא תורם או מקבל של יוני Na, מה שעוזר לשמור על ריכוז קבוע של יוני Na בנוזל החוץ תאי. נתרן הוא היון החוץ-תאי העיקרי. בגוף האדם, נתרן נמצא בצורת המלחים המסיסים שלו, בעיקר כלוריד, פוספט ומימן קרבונט. נתרן מופץ בכל הגוף: בסרום הדם, נוזל מוחי, נוזל עיניים, מיצי עיכול, מרה, כליות, עור, רקמת עצם, ריאות, מוח. יוני Na ממלאים תפקיד חשוב בהבטחת הקביעות של הסביבה הפנימית של גוף האדם ומעורבים בשמירה על לחץ אוסמוטי קבוע של נוזל ביולוגי (הומאוסטזיס אוסמוטי). יוני Na מעורבים בוויסות חילוף החומרים במים ומשפיעים על תפקוד האנזימים. יחד עם היונים K, Mg, Ca, Cl, יון Na מעורב בהעברת דחפים עצביים ושומר על התרגשות תקינה של תאי השריר. כאשר תכולת הנתרן בגוף משתנה, מתרחשים הפרעות בתפקוד של מערכות העצבים, הלב וכלי הדם ואחרות, שרירים חלקים ושלד. נתרן כלורי NaCl משמש כמקור העיקרי לחומצה הידרוכלורית למיץ קיבה. נתרן חודר לגוף האדם בעיקר בצורת מלח שולחן. הצורך היומי האמיתי של הגוף בנתרן הוא 1 גרם, אם כי הצריכה הממוצעת של יסוד זה מגיעה ל-4-7 גרם. צריכה עודפת מתמשכת של NaCl תורמת להופעת יתר לחץ דם. כאשר תאים מיקרוביאליים נחשפים לבסיס, מתרחשת משקעים של חלבונים תאיים וכתוצאה מכך, מוות של מיקרואורגניזמים. נתרן סולפט (מלח גלאובר) Na2SO4 × 10H2O משמש כחומר משלשל. נתרן טטרבוראט Na2B4О7 × 10H2O משמש חיצונית כחומר חיטוי לשטיפה, שטיפה ושימון. נתרן הידרוקסיד בצורה של תמיסה של 10% כלול בהרכב של סילאן, המשמש בתרגול אורטופדי ליציקת מודלים עמידים באש בייצור תותבות מוצקות מסגסוגת קובלט-כרום. תכולת האשלגן בגוף האדם השוקל 70 ק"ג היא כ-160 גרם (4090 ממול) - 0,23%. אשלגן הוא הקטיון התוך תאי העיקרי, המהווה 2/3 מכלל הקטיונים התאיים הפעילים. מתוך כמות האשלגן הכוללת בגוף, 98% נמצאים בתוך התאים ורק כ-2% נמצאים בנוזל החוץ תאי. אשלגן מופץ בכל הגוף. הטופוגרפיה שלו: כבד, כליות, לב, רקמת עצם, שרירים, דם, מוח ועוד. יוני K ממלאים תפקיד חשוב בתהליכים פיזיולוגיים - התכווצות שרירים, תפקוד תקין של הלב, הולכת דחפים עצביים, תגובות מטבוליות. יוני K הם מפעילים חשובים של אנזימים הנמצאים בתוך התא. 38. תפקיד ביולוגי של רכיבי s של קבוצה IIA. השימוש בהם ברפואה (בריליום, מגנזיום, סידן) בריליום נמצא בצמחים וגם בגוף של בעלי חיים. תכולת הבריליום באורגניזמים חיים היא 107%, כלומר זהו אלמנט אולטרה-מיקרו-טומאה. התפקיד הביולוגי של בריליום לא נחקר מספיק. תרכובות בריליום רעילות וגורמות למספר מחלות (רככת בריליום, בריליוזיס ועוד). תרכובות בריליום נדיפות הן רעילות במיוחד. ההשפעה השלילית של Be2+ על תהליכים פיזיולוגיים מוסברת על ידי התכונות הכימיות שלו. מגנזיום מסווג רשמית כמקרו-נוטריינט. התוכן הכולל שלו בגוף הוא 0,027% (כ-20 גרם). הטופוגרפיה של המגנזיום בגוף האדם היא כדלקמן: המגנזיום מרוכז במידה רבה ביותר בדנטין ובאמייל של שיניים ורקמות עצם. הוא מצטבר גם בלבלב, בשרירי השלד, בכליות, במוח, בכבד ובלב. אצל מבוגר, הדרישה היומית למגנזיום היא כ-0,7 גרם. יון Mg, כמו יון K, הוא קטיון תוך תאי. בנוזלים וברקמות הביולוגיות של הגוף, מגנזיום נמצא הן בצורת יון אקווה והן במצב קשור לחלבון בכמות של <102%, כלומר, במהותו, זהו יסוד קורט. ריכוז יוני Mg בתוך התאים גבוה פי 2,5-3 בערך מאשר בנוזלים תאיים. יוני מגנזיום ממלאים תפקיד ביולוגי חשוב בגוף האדם. בשל רדיוס היונים הקטן יותר ואנרגיית היינון הגבוהה יותר Mg2+ יוצר קשרים חזקים יותר מהיון Ca ולכן הוא זרז פעיל יותר לתהליכים אנזימטיים. בהיותו חלק ממערכות אנזימטיות שונות, יון Mg הוא המרכיב והמפעיל החיוניים שלהם (אנזימים כגון carboxypeptidase, cholinesterase ועוד כמה הם ספציפיים ליון Mg). הידרוליזה של ATP, הקשורה למספר תגובות אנזימטיות, כתוצאה ממנה נוצר הידרופוספטיון HPO2 ומשתחררת כמות גדולה של אנרגיה, מתרחשת עם עודף של Mg2+. סידן הוא מאקרו-נוטריינט. התכולה הכוללת שלו בגוף היא 1,4%. סידן נמצא בכל תא בגוף האדם. עיקר הסידן נמצא בעצמות וברקמות השיניים. בממוצע, מבוגר צריך לצרוך 1 גרם סידן ליום, אם כי הצורך בסידן הוא רק 0,5 גרם. סידן הניתן עם מזון נספג רק ב-50% במעיים. ספיגה גרועה יחסית היא תוצאה של היווצרות של סידן פוספט Ca מסיס בקושי במערכת העיכול3(PO4)2 ומלחי סידן של חומצות שומן. בגוף, ריכוז יוני Ca מווסת על ידי הורמונים. בעצמות ובשיניים של מבוגר נמצא כ-1 ק"ג סידן בצורה של מינרל גבישי בלתי מסיס - הידרוקסיאפטיט Ca10(RO4)6(הוא)2 , שהיווצרותם מתרחשת במהלך האינטראקציה של יוני Ca עם פוספטונים. בדם ובלימפה נמצא סידן גם במצב מיונן וגם במצב לא מיונן - בשילוב עם חלבונים, פחמימות וכו'. מנגנון קרישת הדם מורכב ממספר שלבים בהתאם לנוכחות Ca מיונן. יוני Ca לוקחים חלק בהעברת דחפים עצביים, התכווצות שרירים וויסות תפקוד שריר הלב. ריכוז יוני Ca בתוך התא ומחוצה לו, בהתאמה, הוא 106 ו (2,25-2,8) 103 פְּרוּצָה. מכיוון שכמעט ולא נעשה שימוש בסידן בתוך התא, הוא פועל כחומר בניין בגוף - בעצמות ובשיניים. השלד הוא המאגר העיקרי של סידן בגוף. 39. תפקיד ביולוגי של אלמנטים D של קבוצת VIB. השימוש בהם ברפואה כרום נמצא ביצורים צמחיים ובעלי חיים. גוף האדם הבוגר מכיל כ-6 גרם של Cr (0,1%). מתכת כרום אינה רעילה, אך תרכובות Cr(III) ו-Cr(VI) מסוכנות לבריאות. הם גורמים לגירוי בעור, מה שמוביל לדרמטיטיס. קיימת הנחה שלנגזרים של כרום (VI) יש תכונות מסרטנות. 0,25-0,3 גרם אשלגן דיכרומט גורם למוות. תרכובות כרום (VI) משמשות כקוטלי פטריות (חומרים, פטריות - "פטריות", קלדרה - "להרוג"). לתרכובות כרום (III) יש השפעה מועילה על צמיחת הצמח. מוליבדן שייך ל"מתכות החיים", בהיותו אחד האלמנטים הביולוגיים החשובים ביותר. מעמדה המיוחד צוין לפני 20-25 שנים על ידי פ. קרין ול.אוריל. מדענים אלה העלו את הרעיון שהופעת חיים על פני כדור הארץ לא התרחשה באמצעות אבולוציה, אלא שהיא הובאה על ידי ציוויליזציה לא ידועה מהחלל החיצון מכוכבי מוליבדן, שבהם חיים התקיימו הרבה לפנינו. בתהליכים ביוכימיים, מוליבדן משתתף במצבי חמצון VI ו-VI. במצבים אלה הוא יוצר צורות אוקסו יציבות. מוליבדן יוצר קומפלקסים אוקסו יציבים ולכן, ככל הנראה, נכלל באנזימים המבטיחים העברת קבוצות אוקסו. Mo(VI) שולט בדם; אם הליגנד הוא חמצן, אז נוצרים איזופולימוליבדתיון יציבים. עודף מוליבדן במזון משבש את חילוף החומרים של סידן2+ ו-RO4 , הגורם לירידה בחוזק העצם - אוסטאופורוזיס. ייתכן שמתרחשת התקשרות למתחמי פוספומוליבדן. קומפלקסים כאלה יכולים להיחשב כשירי חומצה של חומצות הטרופולימוליבדיות. עם סידן, שאריות אלו יוצרות גבישים בלתי מסיסים. יתכן שגבישים אלו יוזמים שקיעת מלחי חומצת שתן וגורמים לגאוט. גאוט מעוות את המפרקים, ומצדיק את התרגום המילולי שלה - "מלכודת רגליים". בנוסף למתחמי חמצן, מוליבדן יוצר קומפלקסים של הליד (Hal), תיאוציאנט (NCS) וציאניד (CN). מוליבדן הוא חלק מאנזימים שונים. בגוף האדם אלה כוללים אלדהיד הידרוקסידאז, קסנטין דהידרוגנאז וקסנטין אוקסידאז. המשקל המולקולרי של קסנטין אוקסידאז (COX) הוא 250 א. e.m. זהו אנזים המכיל מוליבדן ביונקים. זה יכול לזרז את החמצון של קסנטין ופורינים אחרים, כמו גם אלדהידים. ההמרה של היפוקסנטין וקסנטין לחומצת שתן מזורזת על ידי קסנטין אוקסידאז. ההנחה היא שבמהלך התהליך הקטליטי, מוליבדן יוצר קשר עם החנקן והחמצן של קסנטין. מוליבדן הוא המיקרו-אלמנט החשוב ביותר של צמחים, שכן חומרים פעילים ביולוגית בהשתתפותו מספקים קיבוע חנקן קל: הם הופכים אותו לאמוניה או למוצרים המכילים חנקן. בהשוואה למתכות אחרות בעלות חשיבות תעשייתית, למוליבדן יש רעילות נמוכה. צריכת מוליבדן במזון היא 0,1 - 0,3 מ"ג ליום, אך הצריכה היומית הנדרשת לא נקבעה. מחסור מוליבדן גורם לירידה בפעילות הקסנטין אוקסידאז ברקמות. תכולת מוליבדן מוגזמת גורמת לאוסטאופורוזיס. טונגסטן הוא יסוד קורט. תפקידו בגוף לא נחקר מספיק. הצורה האניונית של טונגסטן נספגת בקלות במערכת העיכול. מתכת טונגסטן וצורותיה הקטיוניות אינן נספגות בגוף. אין מידע על הומאוסטזיס טונגסטן ביונקים. 40. תפקיד ביולוגי של תרכובות מנגן. השימוש בהם ברפואה מבין היסודות מקבוצת VIIB, רק מנגן הוא יסוד ביוגני ואחת מעשר "מתכות החיים" הנחוצות לתפקוד תקין של תהליכים באורגניזמים חיים. גופו של מבוגר מכיל 12 מ"ג. המנגן מרוכז בעצמות (43%), השאר ברקמות רכות, כולל המוח. בגוף, מנגן יוצר מתחמי מתכת עם חלבונים, חומצות גרעין, ATP, ADP וחומצות אמינו בודדות. המטאלו-אנזימים ארגינאז, כולינסטראז, פוספוגלוקומוטאז, פירובאט קרבוקסילאז מכילים מנגן. הקישור של אמוניה, תוצר רעיל של טרנספורמציה של חומצות אמינו בגוף של יונקים, מתבצע באמצעות חומצת האמינו ארגינין. ארגינאז הוא אנזים המזרז את ההידרוליזה של ארגינין בכבד. כתוצאה מכך, ארגינין מתפרק לאוריאה ולחומצת האמינו המחזורית אורניתין. אוריאה היא חומר לא רעיל ומסיס במים. הוא נישא על ידי זרם הדם אל הכליות ומופרש בשתן. הרדיוס האטומי של מנגן הוא 128 pm. זה מסביר את העובדה שמנגן יכול להחליף מגנזיום (רדיוס אטומי 160 pm) בשילוב שלו עם ATP, ומשפיע באופן משמעותי על העברת האנרגיה בגוף. יוני Mg ו-Mn מפעילים גם אנזימים - נוקלאזות. אנזימים אלו מזרזים את ההידרוליזה של חומצות גרעין DNA ו-RNA בתריסריון. כתוצאה מכך, ביו-פולימרים אלו מפוצלים ליחידות מונומר - נוקלאוטידים. בפרט, נוקלאז כזה הוא deoxyribonuclease, אשר מזרז הידרוליזה של DNA רק בנוכחות Mg2+ או MP2+. מנגן יכול להיות גם חלק מתרכובות אנאורגניות בגוף. זהו, למשל, מנגן מגנזיום pyrophosphate MnMgP מסיס גרוע2O7. גבישים של מלח זה ממוקמים על פני השטח הפנימיים של קרום השלפוחית. הערך הכמעט זהה של הרדיוס האטומי של מנגן וברזל מסביר את יכולתו של מנגן להחליף ברזל בקומפלקס הפורפירין של האריתרוציט. מאותה סיבה, מנגן יכול להחליף אבץ גם באנזימים התלויים באבץ, ובכך לשנות את התכונות הקטליטיות שלהם. אשלגן פרמנגנט KMpO4 - תרכובת המנגן המפורסמת ביותר המשמשת ברפואה. השתמש בתמיסות מימיות המכילות KMnO4 0,01-5%. תמיסת 5% משמשת כחומר המוסטטי. לתמיסות של אשלגן פרמנגנט יש תכונות חיטוי, אשר נקבעות על ידי יכולת החמצון הגבוהה שלו. תרכובות מנגן אחרות כוללות מנגן (II) סולפט ומנגן (II) כלוריד, המשמשים לטיפול באנמיה. אין נתונים על נוכחות טכניום באורגניזמים חיים. עם זאת, תרכובות טכנציום עם ביספוספונטים משמשות לשיטות אבחון רדיואיזוטופים. 41. תפקיד ביולוגי של תרכובות ברזל. הֵמוֹגלוֹבִּין ברזל הוא יסוד ביוגני המצוי ברקמות של בעלי חיים וצמחים. המסה הכוללת של ברזל בגוף האדם הבוגר היא בערך 5 גרם, שהם 0,007%. ברזל מתכתי הוא בעל רעילות נמוכה, אך תרכובות Fe (II), Fe (III) ו-Fe (VI) מסוכנות לבריאות בכמויות גדולות. מיוגלובין, ציטוכרומים, קטלאז מספקים נשימה תאית. כל החלבונים הללו מורכבים מחלקי החלבון בפועל וממרכזים פעילים הקשורים אליהם. המרכז הפעיל הוא תרכובת מורכבת מאקרוציקלית - heme. התרכובת פורפירין פועלת כליגנד מקרוציקלי. אטומי חנקן תורם ממוקמים בפינות הריבוע, שבמרכזו נמצא יון ה-Fe. באופן כללי, למתחם יש תצורה אוקטהדרלית. המסלול החמישי דרך חומצת האמינו חנקן (היסטידין) משמש לקישור ההמה לחלבון. המוגלובין מורכב מ-4 מולקולות חלבון (תת-יחידות) היוצרות אגרגט מקרו-מולקולרי יחיד. כל תת-יחידה דומה במבנה למולקולת מיוגלובין. לפיכך, המוגלובין יכול לקשור בו זמנית ארבע מולקולות O2 ומיוגלובין - 1. ישנם גם מספר קומפלקסים חלבוניים שאינם מכילים ברזל ברקמות. מדובר, למשל, באנזימים - אוקסידאזים, וכן בחלבוני אגירה (מחסנים) ומעבירי ברזל. עודף ברזל מועבר בדם על ידי החלבון טרנספרין ומצטבר בצורת החלבון פריטין ברקמות ואיברים שונים, בעיקר בכבד, בטחול ובמח העצם. פריטין מורכב מ-24 מולקולות חלבון (יחידות משנה) היוצרות כדור בקוטר של 12-14 ננומטר. כל תת-יחידה מכילה חלל בקוטר של 7 ננומטר, המכיל עד 4500 אטומי ברזל. לפיכך, כל אגרגט פריטין יכול לאחסן רזרבה של כ-100 אטומי ברזל, מה שמאפשר תגובות מטבוליות רבות הכוללות יסוד זה. בהתבסס על חוקי שיווי המשקל הכימי, לא קשה להבין את תפקודו של המוגלובין כנשא של חמצן מהריאות לרקמות. המוגלובין ללא חמצן (דאוקסיהמוגלובין) הוא חומצה חלשה וניתן לייצג את הנוסחה הכימית שלה כ-HHb+. תוספת חמצן מלווה בסילוק פרוטון ויצירת אוקסיהמוגלובין HbO2 . במקרה זה יש שיווי משקל: HHb+ + O.2 → HbO2 + H+. כאשר דם ורידי דל בחמצן חודר לריאות, שם הלחץ החלקי של החמצן גבוה (עד 20 kPa), מסיסותו עולה על פי חוק הנרי. זה מוביל, בהתאם לעיקרון של Le Chatelier, לשינוי שיווי משקל ימינה ולהיווצרות אוקסיהמוגלובין. תזוזה נוספת של שיווי משקל ימינה נובעת מכך שבריאות ערך ה-pH גדל (עד 7,5). כתוצאה מכך, ה-deoxyhemoglobin בריאות רווי כמעט לחלוטין (עד 97%) בחמצן והופך לא-oxyhemoglobin. בנימים החודרים לרקמות היקפיות, הלחץ החלקי של החמצן יורד ל-5 kPa, וערך ה-pH יורד ל-7,2. כתוצאה מכך, האיזון עובר שמאלה. בדם הזורם מהפריפריה המוגלובין רווי בחמצן רק ב-65%. 42. תפקיד ביולוגי של תרכובות ברזל. פחמן חד חמצני CO. תכונות קומפלקס המתכות של חלבונים המכילים heme מתבטאות בהשפעת חומרים רעילים כגון CO (חד חמצני פחמן) ו-MCN (ציאניד - מלחי חומצה הידרוציאנית). החשובים ביותר מנקודת מבט פיזיולוגית הם חלבונים המכילים ברזל: המוגלובין, מיוגלובין, ציטוכרומים, פרוקסידאזים, קטלאז. המוגלובין הוא המרכיב העיקרי של תאי דם אדומים, מספק נשימה חיצונית, בהיותו נשא של חמצן מהריאות לרקמות. ברזל פה וקובלט Co הם מיקרו-אלמנטים חיוניים עבור אורגניזמים חיים. פחמן חד חמצני CO הוא אחד התוצרים של בעירה לא מלאה של דלק. כמויות משמעותיות של גז זה משתחררות במהלך פעולת דוודים, מנועי בעירה פנימית ועישון. כאשר CO נשאף עם אוויר בריאות במקביל ל- oxyhemoglobin HbO2 נוצרת תרכובת מורכבת מתכת - קרבוניל-המוגלובין HbCO. קבוע היציבות של HbCO גדול פי 200 בערך מזה של HbO2 . לכן, אפילו כמויות קטנות של CO "מיירטות" חלק ניכר מהדאוקסיהמוגלובין, וכתוצאה מכך אספקת החמצן לאיברים פוחתת. מופיעים סימנים של היפוקסיה - מחסור בחמצן. רקמות העצבים הן הראשונות שנפגעות. כדי לסלק את הרעלים (להעלים את ההשפעה הרעלית) של פחמן חד חמצני, במקרים רבים די לעצור את אספקתו ולהגביר את אוורור החמצן - קחו את הקורבן לאוויר צח. במקרה זה, העיקרון של Le Chatelier עובד שוב - שיווי המשקל עובר לכיוון היווצרות אוקסיהמוגלובין. בריכוזים גבוהים, פחמן חד חמצני חוסם חלבונים המכילים heme של הנשימה התאית, וקשה להימנע ממוות. מנגנון הפעולה של ציאניד דומה, אך רעילותם גבוהה מזו של CO. כניסת אפילו כמויות קטנות מאוד של חומרים אלו לדם מובילה לעצור נשימה ולמוות. הרעילות הגבוהה של ציאניד מוסברת על ידי החוזק הגבוה של הקשר Fe-CN-, שהופך את ההמוגלובין ציאניד ליציב יותר. נשימת חמצן מובילה ליצירת מי חמצן H2O2 . לחומר זה יכולת חמצון גבוהה. כאשר הוא יוצר אינטראקציה עם תרכובות ביו-אורגניות של תאים, נוצרים רדיקלים - חלקיקים מולקולריים פעילים מאוד עם ערכיות בלתי רוויה, ומתחיל חמצון של מי חמצן. בהשפעת רדיקלים, המרכיבים החשובים ביותר של התא - ממברנות ו-DNA - מושמדים. במהלך האבולוציה הביולוגית, הטבע פיתח חלבון מיוחד - האנזים קטלאז, המשמיד את מי חמצן. זה מגביל את הצטברות יתר של חומר זה ומונע הרס תאים. פעולת הקטלאז (CatFe2+ ) ניתן לייצג כמחזור קטליטי של שתי תגובות עוקבות: CatFe2+ + H2O2 - CatFe2+ × N2O2 , CatFe2+ × N2O2 + H2O2 → CatFe2+ + 2H2O2 + O.2 . כתוצאה מכך, 2 מולקולות של מי חמצן נהרסות, ומולקולת הביו-קטליזטור CatFe2+ משתחררת ויכולה להיכנס למחזור הקטליטי הבא. תהליך זה מהיר מאוד. תוך שנייה, מולקולת קטלאז אחת יכולה לבצע עד 1 מחזורים. 43. תפקיד ביולוגי של תרכובות ברזל וקובלט אם יש חוסר בברזל בגוף יכולה להתפתח מחלה - אנמיה מחוסר ברזל (אנמיה). מחסור בחמצן ברקמות מתרחש עקב מחסור בברזל לסינתזה של המוגלובין. כתוצאה מכך, אספקת החמצן לאיברים היקפיים מופחתת, ובהתאם לכך רמת הנשימה התאית יורדת וחילוף החומרים מואט. מתן ברזל (II) כלוריד או ברזל (II) סולפט כתרופות מפחית את חומרת המחלה. לאותן מטרות משתמשים באבקת ברזל מתכתי מפוזרת דק (ברזל מופחת, עד 1 גרם לכל מנה), שמתמוססת בקלות בחומצה הידרוכלורית של מיץ קיבה. לכן, הפעולה של תרופה זו דומה לפעולה של ברזל (II) כלוריד. עם זאת, תכשירים שהם קומפלקסים ביו-אורגניים של ברזל עם סוכרים, ניקוטינמיד וחומרים אורגניים אחרים יעילים יותר. קומפלקסים כאלה נספגים היטב בדם, וזו הסיבה שהיעילות הפרמקולוגית שלהם קשורה. מעניין לציין כי מימי קדם ועד ימינו נעשה שימוש במה שנקרא יין הברזל, משקה המיוצר על ידי חליטת יין ענבים על סיבי ברזל, לטיפול באנמיה מחוסר ברזל. ברור שהברזל מתמוסס ביין (תווך חומצי) ויוצר קומפלקסים עם חומרים אורגניים טבעיים, אותם הוא מכיל בכמויות גדולות. ברור שמנגנון הפעולה של המשקה העתיק זהה בערך לזה של התרופות המודרניות. כמו ברזל, גם קובלט הוא אחד היסודות הביוגניים החשובים ביותר. המסה הכוללת של קובלט בגוף האדם הבוגר היא כ-1,2 מ"ג, שהם פחות מ-10%. כ-100 מ"ג מהמסה הזו הם בצורת ציאנוקובלמין (וויטמין B מסיס בשומן12 ) והאנלוגים שלו. חומר זה, כמו heme, הוא תרכובת מורכבת מאקרוציקלית. תרכובת הטטרדנטאט, פורפין, פועלת כליגנד מקרוציקלי. R מייצג תחליף אורגני מורכב. באנלוגים של ציאנוקובלמין, תחליפים אורגניים שונים מחליפים את האניון CN. התפקיד החשוב ביותר של ויטמין B12 משחק בפיתוח ויצירת תאי דם אדומים (אריתרופואיזיס). מחסור בוויטמין B12 (צריכה של פחות מ-3 מק"ג ליום) מובילה למחלה קשה - אנמיה מזיקה (אנמיה). הוכח כי אנלוגים של ציאנוקובלמין הם מפעילים - קו-פקטורים של אנזימים שונים המעורבים באריתרופואיזיס. המחסור בקופקטורים מתבטא במחסור בהמוגלובין ובכדוריות דם אדומות. צמחים ובעלי חיים אינם יכולים לסנתז ויטמין B12. הוא מיוצר רק על ידי סוגים מסוימים של חיידקים. ישנם חיידקים כאלה במערכת העיכול האנושית. הם מסנתזים כמויות מספקות של ויטמין B12. אנמיה מזיקה קשורה לפגיעה בספיגה של ויטמין זה לדם. לכן נטילת גלולות אינה יעילה. הזרקת ויטמין (100-200 מק"ג למשך יומיים) לדם משפרת משמעותית את מצבו של חולה עם אנמיה ממאירה. 44. תפקידם של אלמנטים D של קבוצת IB. יישום התרכובות שלהם ברפואה נחושת Cu הוא מיקרו-אלמנט חיוני עבור אורגניזמים חיים. כסף Ag וזהב Au הם יסודות קורט. התרכובות שלהם משמשות ברפואה. נחושת היא יסוד ביוגני המצוי ברקמות של בעלי חיים וצמחים. המסה הכוללת של נחושת בגוף האדם הבוגר היא כ-100 מ"ג, שהם כ-0,0001%. כ-30% מכמות זו מצויה בשרירים. גם הכבד והמוח עשירים בנחושת. נחושת מתכתית ותרכובותיה רעילות. החשובים ביותר מנקודת מבט פיזיולוגית הם חלבונים המכילים נחושת - ציטוכרום אוקסידאז וסופראוקסיד דיסמוטאז. ציטוכרום אוקסידאז הוא אחד המרכיבים של שרשרת הנשימה הממוקמת בממברנות המיטוכונדריות. מספק נשימה תאית על ידי הפחתת חמצן למים בחלק האחרון של שרשרת הנשימה. הגוף דורש 2,5-5,0 מ"ג נחושת מדי יום. אם יש חוסר נחושת בגוף יכולה להתפתח מחלה - אנמיה מחוסר נחושת. נחושת נחוצה לספיגה של ברזל, במיוחד בסינתזה של ציטוכרום אוקסידאז, המכיל ברזל ונחושת כאחד. עם מחסור בנחושת, ההתפתחות התקינה של רקמות חיבור וכלי דם מופרעת. הרעלה קשורה בדרך כלל עם מנת יתר מקרית של קוטלי חרקים, שאיפה של אבקת מתכת ובליעה של תמיסות של מלחי נחושת. משקאות המאוחסנים בכלי נחושת ללא ציפוי מגן על הקירות מהווים סכנה גדולה. כסוכן חיצוני, השתמש בתמיסה מימית של 0,25% של נחושת גופרתית CuSO4 עם דלקת של הממברנות הריריות ודלקת הלחמית. ניתן להשתמש במינונים קטנים של תרופה זו במהלך הארוחות כדי לשפר את האריתרופואיזיס באנמיה. כסף וזהב בגוף האדם הבוגר, נמצא כ-1 מ"ג כסף, כלומר כ-10% (1 חלק למיליון), ועד 10 מ"ג של זהב, כלומר כ-10% (10 חלקים למיליון). התכונות האנטיספטיות של מלחי כסף מסיסים ידועות עוד מימי קדם. אנשי הדת יודעים זה מכבר כי מים ("קדושים"), כאשר הם מאוחסנים בכלי כסף, אינם מתקלקלים לאורך זמן, כלומר אינם נתונים לזיהום מיקרוביאלי. נכון לעכשיו, מאפיין זה של מי "כסף" משמש מלחים במסעות ארוכים. השפעות רעילות חמורות אצל מבוגר נצפו לאחר בליעה של 7 גרם של AgNO3. תרופות כגון חנקתי כסף גבישי AgN03 (לאפיס) ותמיסותיו המימיות נמצאות זמן רב בשימוש ברפואה. תכשירי כסף מתכתי קולואידי, פרוטארגול (8% Ag) ו-Collargol (70% Ag), שהן אבקות עדינות בעלות ברק מתכתי, ידועים גם הם מזה זמן רב. כל חלקיק של אבקות כאלה הוא גביש של כסף מתכתי מופחת בגודל של פחות ממיקרון אחד עם מעטפת חלבון של אלבומין (פרוטארגול) או קולגן (קולרגול). מעטפת החלבון מגינה על גבישי הכסף מהיצמדות זה לזה ומבטיחה את מעברם לסביבה המימית (מתמוססת). תכשירי כסף משמשים כנוגדי דלקת, חיטוי וחומרים עפיצים. תכשירי זהב משמשים גם כתרופות אנטי דלקתיות יעילות. המפורסמים ביותר הם כריזנול עם 30% תכולת מתכות אצילות וזהב קולואידי. 45. תפקיד ביולוגי של יסודות D של קבוצה IIB. יישום התרכובות שלהם ברפואה אבץ Zn, קדמיום Cd, כספית Hg - יסודות קורט. גוף האדם הבוגר מכיל 1,8 גרם Zn, 50 מ"ג Cd, 13 מ"ג כספית. קדמיום וכספית הם יסודות טומאה. כ-70% מהכספית מרוכזת בשומן וברקמת השריר. קדמיום ממוקם 30% בכליות, השאר בכבד, בריאות ובלבלב. אבץ הוא מרכיב חיוני לכל הצמחים ובעלי החיים. בגוף הבוגר, הכי הרבה אבץ נמצא בשרירים (65%) ובעצמות (20%). השאר מגיע מפלסמת דם, כבד ותאי דם אדומים. הריכוז הגבוה ביותר של אבץ נמצא בבלוטת הערמונית. אבץ אינו מציג ערכיות משתנה. ככל הנראה, זו הסיבה שהביו-קומפלקסים שלו לוקחים חלק בתגובות הידרוליזה ביוכימיות רבות המתרחשות ללא העברת אלקטרונים. יון Zn הוא חלק מיותר מ-40 מטלו-אנזימים המזרזים את ההידרוליזה של אסטרים וחלבונים. אחד הנחקרים ביותר הוא קומפלקס האבץ הביו-אי-אורגני - האנזים פחמן אנהידראז (Mg = 30), המורכב מכ-000 שיירי חומצות אמינו. אבץ אינו חלק מדיפפטידאזים - אנזימים המזרזים הידרוליזה של דיפפטידים (חומרים המורכבים מ-2 חומצות אמינו). אבץ יוצר קומפלקס ביו-אורגני עם אינסולין, הורמון המווסת את רמת הסוכר בדם. הצורך האנושי באבץ מסופק במלואו על ידי מוצרי מזון: בשר, מוצרי חלב, ביצים. עם מחסור באבץ בצמחים, חילוף החומרים של חלבון ופחמימות מופרע, והסינתזה של כלורופיל וויטמינים מעוכבת. מחסור באבץ מסולק על ידי שימוש בדשנים המכילים אבץ. הרעילות של תרכובות מקבוצה IIB עולה מאבץ לכספית. תרכובות מסיסות במים מגרים את העור וגורמות להרעלה בבליעה. גם המתכות עצמן רעילות - כאשר שואפים אדי אבץ (אוויר מייצור אבץ), מופיעה קדחת "מתכת". הרעלת אדי כספית בימי הביניים כונתה "מחלת הכובען המטורף". רמות הכספית במזונות (מאכלי ים, כמו ביפן) מובילות למחלת המינומטה. רעילות כספית קשורה לאגלוטינציה (היצמדות זו לזו) של כדוריות דם אדומות ועיכוב אנזימים. כך למשל, סובלימציה גורמת לשינוי בגודל, לשבריריות אוסמוטית ולירידה בכושר העיוות של תאי הדם האדומים, הנחוצה לתנועתם דרך הנימים. הרעילות של קדמיום קשורה לזיקה שלו לחומצות גרעין. כתוצאה מהתקשרותו ל-DNA, תפקודו מופרע. שיכרון קדמיום וכספית כרוני עלול לפגוע במינרליזציה של העצם. יסודות רעילים יכולים להחליף סידן. זה מוביל להיווצרות אפטות של מבנה לא מושלם עקב עיוות של הפרמטרים של המרכיב הגבישי של רקמת העצם. כתוצאה מכך, חוזק העצם פוחת. 46. תכונות רעילות של תרכובות מקבוצה IIB (Zn, Cd, Hg) תרכובות של Zn, Cd, Hg עלולות לגרום להפרעה בחילוף החומרים של החלבון, המתבטא בשחרור חלבוני פלזמה דרך הכליות (פרוטאינוריה). ההשפעה הרעילה של תרכובות קבוצת IIB על הגוף נגרמת גם מהעובדה שיונים של מתכות אלה מתקשרות עם קבוצות הסולפהדריל SH של חלבונים, אנזימים וחומצות אמינו. כאשר יוני מתכת מקיימים אינטראקציה עם קבוצות SH, נוצרות תרכובות מתנתקות חלש וככלל בלתי מסיסות. לכן, חסימת קבוצות sulfhydryl מובילה לדיכוי פעילות האנזים וקיפול חלבון. יוני מתכת דו ערכיים חוסמים שתי קבוצות SH בו זמנית. בתגובות מסוג זה, יוני מתכת פועלים כמקבל, והגופרית פועלת כתורם אלקטרונים. הזיקה הכימית לקבוצות SH בולטת ביותר לכספית. ברור שזה נובע מהעובדה שתכונות המורכבות של כספית גבוהות יותר והיא יוצרת קשרים חזקים יותר עם גופרית. קבוצות SH הן חלק מיותר מ-100 אנזימים, אשר ניתן לדכא את פעילותם עקב חסימה של קבוצות אלו. לכן, ברור עד כמה חשוב להכיר את מנגנון החסימה ושיטות הטיפול להרעלת מתכות של הגוף. ידוע כי התכונות הרעילות של יסודות תלויות בצורה הכימית בה הם נכנסים לגוף. הצורות הרעילות ביותר הן אלו שמתמוססות בשומנים וחודרות בקלות לממברנת התא. הספרות מתארת מקרה של הרעלת כספית המונית ביפן. תרכובות כספית אנאורגניות הומרו למתיל כספית בפעולת אנזימים מיקרוביאליים. מתיל כספית הצטברה בדגים ולאחר מכן נכנסה לגוף האדם דרך המזון. מתיל כספית מתרכז בהדרגה, גורם להרס בלתי הפיך בגוף ולמוות. השימוש בתרכובות אבץ וכספית ברפואה מבוסס על השפעותיהם העפיצות, המצריבות והחיטוי. תמיסה מימית של 0,25% של אבץ סולפט ZnSO משמשת כטיפות עיניים.4. ברפואת שיניים, אבץ כלוריד משמש לצריבה של פפילומות ולטיפול בריריות דלקתיות. תחמוצת אבץ ZnO משמש גם. כספית (II) כלוריד (כספית כלוריד) רעיל מאוד, והתמיסות המימיות שלו בדילול גבוה (1:1000) משמשות לחיטוי. לטיפול במחלות עור ומחלות מין, משתמשים במשחות המכילות כספית (II) תחמוצת HgO וכספית (II) גופרתי HgS. כספית(I) כלוריד (קלומל) מסיס בצורה גרועה במים ולכן רעיל מעט. מלח זה משמש ברפואה וטרינרית כחומר משלשל. כספית בתנאים רגילים היא מתכת נוזלית המסוגלת להמיס מתכות אחרות. במקרה זה נוצרות סגסוגות קשות - אמלגם. ברפואת השיניים, אמלגמים של כסף וקדמיום משמשים זה מכבר למילוי שיניים. הם אינרטיים מבחינה כימית, מתרככים בקלות בחימום ולכן קל לעצב אותם. מקורות אור אולטרה סגול - מנורות כספית-קוורץ לשימוש רפואי - מכילים כספית גזית (אדים). כאשר מקרינים באור מנורות אלה בחצרי בית החולים, מיקרואורגניזמים הכלולים באוויר נהרסים. מחלות עור שונות מטופלות בעזרת קרניים אולטרה סגולות. לפיכך, לפי אופי תפקודן והשפעתן על הגוף, ניתן לחלק את מתכות מקבוצת IIB ליסוד החיוני Zn וליסודות הטומאה הרעילים Cd ו-Hg. 47. תפקיד ביולוגי של יסודות p מקבוצה IIIA. יישום התרכובות שלהם ברפואה בורון הוא יסוד קורט; חלק המסה שלו בגוף האדם הוא 105%. בורון מרוכז בעיקר בריאות (0,34 מ"ג), בלוטת התריס (0,30 מ"ג), טחול (0,26 מ"ג), כבד, מוח (0,22 מ"ג), כליות, שריר לב (0,21 מ"ג). ההשפעה הביולוגית של בורון עדיין לא נחקרה מספיק. ידוע כי בורון כלול בהרכב השיניים והעצמות, ככל הנראה בצורה של מלחים מסיסים במשורה של חומצה בורית עם קטיוני מתכת. עודף בורון מזיק לגוף האדם. ישנן עדויות לכך שעודף בורון מעכב עמילאזים, פרוטאינזים ומפחית את פעילות האדרנלין. מבחינת תוכן בגוף האדם (105%), אלומיניום מסווג כיסוד קורט. האלומיניום מרוכז בעיקר בסרום דם, ריאות, כבד, עצמות, כליות, ציפורניים, שיער, ומהווה חלק ממבנה קרומי העצבים של המוח האנושי. הצריכה היומית של אלומיניום על ידי בני אדם היא 47 מ"ג. האלומיניום משפיע על התפתחות רקמות האפיתל והחיבור, התחדשות רקמת העצם ומשפיע על חילוף החומרים של זרחן. אלומיניום משפיע על תהליכים אנזימטיים. עודף אלומיניום בגוף מעכב את סינתזת המוגלובין, שכן, בשל יכולתו הגבוהה למדי ליצירת קומפלקס, אלומיניום חוסם את המרכזים הפעילים של אנזימים המעורבים בהמטופואזה. ישנן עדויות לכך שאלומיניום יכול לזרז את תגובת הטרנסאמינציה. גליום הוא מיקרו-אלמנט של טומאה (התוכן בגוף האדם הוא 10-6-10-5אחוזים. התפקיד הביולוגי של גליום באורגניזמים חיים כמעט ואינו ידוע. תליום הוא יסוד רעיל מאוד. יון T1 נוטה, כמו Ag+, ליצור תרכובות חזקות עם ליגנדים המכילים גופרית. כתוצאה מכך הוא רעיל מאוד, שכן הוא מעכב את פעילותם של אנזימים המכילים קבוצות תיו - SH. אפילו כמויות קטנות מאוד של תרכובות T1+, בעת בליעה, גורמות לנשירת שיער. בשל סמיכות הרדיוסים K+ ו-T1+ יש להם תכונות דומות והם מסוגלים להחליף זה את זה באנזימים. יוני T1 ו-K הם סינרגיסטים. זה מסביר את העובדה שהאנזימים פירובאט קינאז ודיול דהידדראז מופעלים לא רק על ידי יוני K, אלא גם על ידי יוני T1 (יון T1 מחליף את יון K במרכז הקטליטי של האנזימים). הסינרגיה של תליום ואשלגן מתבטאת גם בכך שכמו יוני K, יוני T1 מצטברים באריתרוציטים. כתרופה נגד הרעלת יון T1, נעשה שימוש בליגנד המכיל גופרית, חומצת האמינו ציסטין. לסיכום, יש לציין שהתפקיד הביולוגי של אלמנטים מקבוצה IIIA לא נחקר מספיק. כיום ידוע כי בורון וגליום מקיימים אינטראקציה בצמחים עם פוליפנולים, מעכבי התפתחותם, ומפחיתים את הרעילות של האחרונים. התבססו גם תפקידו הבלתי מעורער של האלומיניום בבניית רקמות אפיתל וחיבור ובנוסף, השתתפותו בתהליכים אנזימטיים, הן כמפעיל והן כמעכב. ליון T1 יש יכולת לעכב אנזימים רבים המכילים גופרית. הפעילות הביולוגית של יסודות קבוצה IIIA קשורה בעיקר ליכולתם ליצור תרכובות מורכבות עם ליגנדים המכילים חמצן ופוספטים בלתי מסיסים. 48. תפקיד ביולוגי של אלמנטי p של קבוצת IVA. יישום התרכובות שלהם ברפואה מבחינת התוכן בגוף האדם (21,15%), הפחמן שייך למרכיבי המאקרו. זה חלק מכל הרקמות והתאים בצורה של חלבונים, שומנים, פחמימות, ויטמינים והורמונים. מנקודת מבט ביולוגית, פחמן הוא האורגנוגן מספר 1. מבחינת התוכן בגוף האדם (103%-), הסיליקון מסווג כמיקרו-אלמנט של טומאה. הכי הרבה סיליקון נמצא בכבד, בבלוטות יותרת הכליה, בשיער ובעדשה. מכיוון שסיליקון דו חמצני טבעי מסיס בצורה גרועה במים, הוא חודר לגוף האדם לא כל כך דרך מערכת העיכול אלא דרך האוויר דרך הריאות בצורה של SiO מאובק2. הפרות של חילוף החומרים של סיליקון קשורות להתרחשות של יתר לחץ דם, שיגרון, כיבים ואנמיה. בפרקטיקה הרפואית, סיליקון קרביד (IV) SiC - קרבורונדום - משמש לטחינת סתימות ותותבות פלסטיק. סיליקון דו חמצני SiO2 הוא חלק מצמנטים סיליקט. יש לציין שאבק המורכב מחלקיקי פחם, צורן דו חמצני ואלומיניום, בחשיפה שיטתית לריאות, גורם למחלה - פנאומוקונוזיס. כאשר נחשפים לאבק פחם, מדובר באנתרקוזיס, מחלת מקצוע של כורים. אם אתה שואף אבק המכיל S1O2 , מתרחשת סיליקוזיס, וכאשר נחשפים לאבק אלומיניום - אלומינוזיס. לפי תוכן בגוף האדם (10-6-10-5%) גרמניום הוא מיקרו-אלמנט. התפקיד הביולוגי לא הובהר במלואו. תרכובות גרמניום משפרות את תהליכי ההמטופואזה במח העצם. ידוע גם שתרכובות גרמניום הן רעילות נמוכות. לפי תוכן בגוף האדם (104 %) פח הוא מיקרו-אלמנט. הפח חודר לגוף האדם עם מזונות חומציים שנשמרו בקופסאות פח המצופים בשכבת פח. בסביבה חומצית, בדיל מתמוסס וחודר לדם בצורה של מלח, ומפגין השפעה רעילה. עם זאת, בניסויים על חולדות נמצא שלפח בכמויות קטנות יש השפעה מעוררת על גדילת החולדות. זה נותן סיבה להניח שזה נחוץ גם לבני אדם. כמובן, הבהרת התפקיד הביולוגי של יסוד קורט זה דורש מחקר נוסף. חומרים שונים משמשים בפרקטיקה הרפואית, בפרט חומרי מילוי המכילים פח. לפיכך, הפח הוא חלק מאמלגם כסף (28%) להכנת סתימות. עופרת ותרכובותיה, במיוחד אורגניות, רעילות מאוד. תרכובות עופרת משפיעות על סינתזת החלבון, על מאזן האנרגיה של התא והמנגנון הגנטי שלו. גורמים רבים מעדיפים את מנגנון הדנטורציה. הוכח שעופרת היא אחד המרכיבים שנוכחותו במזון משפיעה על התפתחות העששת. עם מזון, מים ואוויר אטמוספרי, אדם סופג עד 100 מק"ג של עופרת בכל יום. עופרת מושקעת בעיקר בשלד (עד 90%) בצורה של פוספט מסיס בקושי. חלק המסה של עופרת בגוף האדם הוא 106%. צריכה יומית של 0,2-2 מ"ג עופרת נחשבת בטוחה לבני אדם. בתרגול רפואי, עופרת אצטט (תחליבים) ותחמוצת עופרת (II) PbO (חלק מטיח העופרת הפשוט) שימשו כחומרי חיטוי חיצוניים. 49. תפקיד ביולוגי של אלמנטים p של קבוצת VA. השימוש בתרכובות שלהם ברפואה (חנקן, זרחן) תכולת החנקן בגוף האדם (3,1%) שייכת למקרו-אלמנטים. אם ניקח בחשבון רק את מסת החומר היבש של הגוף (ללא מים), אז תכולת החנקן בתאים היא 8-10%. יסוד זה הוא מרכיב של חומצות אמינו, חלבונים, ויטמינים והורמונים. חנקן יוצר קשרים קוטביים עם אטומי מימן ופחמן בביומולקולות. בקומפלקסים ביו-אי-אורגניים רבים (מטלו-אנזימים), אטומי חנקן קושרים את החלקים האנאורגניים והאורגניים של המולקולה באמצעות מנגנון מקבל תורם. יחד עם חמצן ופחמן, חנקן יוצר תרכובות חיוניות - חומצות אמינו, המכילות בו זמנית קבוצת אמינו בעלת תכונות בסיסיות וקבוצת קרבוקסיל (-COOH) בעלת תכונות חומציות. קבוצת האמינו גם מבצעת תפקיד חשוב מאוד במולקולות חומצת גרעין. המשמעות הפיזיולוגית של ביוליגנדים המכילים חנקן – פורפירינים, למשל המוגלובין, היא עצומה. מחזור החנקן מתרחש בביוספרה. מחזור החנקן חיוני לחקלאות. יש לציין עוד תכונה חשובה מבחינה ביולוגית של חנקן - מסיסותו במים כמעט זהה לזו של חמצן. נוכחות של עודף חנקן בדם יכול לגרום להתפתחות של מחלת דקומפרסיה. כאשר צוללים עולים במהירות, מתרחשת ירידה חדה בלחץ, מסיסות החנקן בדם יורדת בהתאם (חוק הנרי), ובועות של חנקן יסודי היוצאות מהדם סותמות כלי דם קטנים, מה שעלול להוביל לשיתוק ולמוות. לפי תכולתו בגוף האדם (0,95%), זרחן מסווג כמקרו-נוטריינט. זרחן הוא יסוד אורגנוגן וממלא תפקיד חשוב ביותר בחילוף החומרים. בצורת פוספט, זרחן הוא מרכיב חיוני של ATP תוך תאי. הוא חלק מחלבונים (0,5-0,6%), חומצות גרעין, נוקלאוטידים ותרכובות אחרות פעילות ביולוגית. זרחן הוא הבסיס לשלד של בעלי חיים ובני אדם (סידן אורתופוספט, הידרוקסיאפטיט), שיניים (הידרוקסילאפטיט, פלואורפטיט). תגובות ביו-סינתטיות רבות מתבצעות על ידי העברה של קבוצות פוספט מקולט באנרגיה גבוהה לקולט באנרגיה נמוכה. מערכת חיץ הפוספט היא אחת ממערכות החיץ העיקריות בדם. אורגניזמים חיים לא יכולים להסתדר בלי זרחן. חשיבותו של הזרחן נעוצה גם בעובדה שסוכרים וחומצות שומן אינם יכולים לשמש את התאים כמקורות אנרגיה ללא זרחון מוקדם. חילוף החומרים של זרחן בגוף קשור קשר הדוק לחילוף החומרים של סידן. זה מאושר על ידי ירידה בכמות הזרחן האנאורגני עם עלייה ברמות הסידן בדם (אנטגוניזם). הצורך היומי של האדם לזרחן הוא 1,3 גרם. זרחן נפוץ כל כך במוצרי מזון עד שמקרים של מחסור ברור שלו (הרעבה בפוספט) כמעט ולא ידועים. עם זאת, לא ניתן לספוג את כל הזרחן הכלול במוצרי מזון, שכן ספיגתו תלויה בגורמים רבים: pH, היחס בין תכולת הסידן והזרחן במזון, נוכחות חומצות שומן במזון, אך בעיקר בתכולת ויטמין D. מספר תרכובות זרחן משמשות כתרופות. יש לציין כי תרכובות זרחן אורגניות המכילות את הקשר C-P הן רעל עצבים חזק ומהוות חלק מחומרי לוחמה כימיים 50. תפקיד ביולוגי של אלמנטים p מקבוצת VA (ארסן, אנטימון, ביסמוט). השימוש בהם ברפואה מבחינת תוכן בגוף האדם, ארסן מסווג כיסוד קורט. הוא מרוכז בכבד, בכליות, בטחול, בריאות, בעצמות ובשיער. רוב הארסן נמצא ברקמת המוח ובשרירים. ארסן מצטבר בעצמות ובשיער ואינו מוסר מהן לחלוטין במשך מספר שנים. תכונה זו משמשת בבדיקה משפטית כדי לקבוע אם התרחשה הרעלה עם תרכובות ארסן. קביעת הארסן בחומר ביולוגי מתבצעת במכשיר פשוט באמצעות תגובת מארש: אבץ וחומצה הידרוכלורית מתווספים לאובייקט הביולוגי. המימן המשתחרר במהלך התגובה מפחית כל תרכובת ארסן לארסין. אם המימן המשתחרר מכיל תערובת של ארסין, אז כאשר תערובת הגז מחוממת, AH מתפרק3 : 2AsH3 = 2As° + 3H2. ועל דפנות צינור שחרור הגז נוצר ציפוי שחור מבריק של ארסן - "מראת ארסן". תגובת המארש רגישה מאוד ומאפשרת לזהות 7-107 g ארסן. במינונים גדולים יחסית, תרכובות ארסן רעילות מאוד. כפי שכבר הוזכר, ההשפעה הרעילה של תרכובות ארסן נובעת מחסימת קבוצות sulfhydryl של אנזימים וחומרים פעילים ביולוגית אחרים. על פי תוכנם בגוף האדם (10%), אנטימון וביסמוט נחשבים למיקרו-אלמנטים. על פי הסיווג של V.V. Kovalsky, אנטימון וביסמוט מסווגים כחברים בקבוצת המיקרו-אלמנטים שנמצאים כל הזמן באורגניזמים חיים, אך תפקידם הפיזיולוגי והביוכימי אינו ידוע כמעט. התפקיד הפיזיולוגי של האנטימון דומה ככל הנראה לארסן. יונים של ארסן As ושל אנטימון Sb ובמידה פחותה, ביסמוט Bi הם סינרגיסטים. לפיכך, ידוע כי במחוזות ביו-גיאוכימיים עם עודף של ארסן באורגניזמים, התוכן של לא רק ארסן, אלא גם אנטימון עולה. במקרה זה, שני האלמנטים מצטברים בבלוטת התריס של התושבים, מעכבים את תפקודו וגורמים לזפק אנדמי. הסינרגיה בין ארסן לאנטימון קשורה ליכולתם ליצור תרכובות עם ליגנדים המכילים גופרית. ביסמוט נוטה יותר להיקשר לליגנדים המכילים קבוצות אמינו. לפיכך, כניסת תרכובות ביסמוט מסיסות לגוף מובילה לעיכוב של אנזימי אמינו וקרבוקסיפוליפפטידאז. בליעה של תרכובות אנטימון מסיסות במים, כגון סטיבין SbH3, בגוף יש השפעה רעילה הדומה לתרכובות ארסן. תרכובות ביסמוט רעילות גם כשהן מוזרקות. לדוגמה, עבור כלבים המינון הקטלני הוא 6 מ"ג/ק"ג משקל גוף. עם זאת, כאשר רוב התרכובות של אנטימון וביסמוט נכנסות למערכת העיכול, אין להן השפעה רעילה כמעט. הרעילות החלשה של תרכובות אלו נובעת מכך שמלחי Sb (III), Bi (III) במערכת העיכול עוברים הידרוליזה ליצירת מוצרים מסיסים גרועים שאינם נספגים בדפנות מערכת העיכול. זהו הבסיס לשימוש בתכשירים רפואיים של אנטימון וביסמוט, למשל, חנקתי ביסמוט בסיסי. 51. תפקיד ביולוגי של אלמנטים p של קבוצת VIA. יישום התרכובות שלהם ברפואה מבחינת תכולה בגוף האדם (62%), חמצן מסווג כמקרו-נוטריינט. הוא בלתי ניתן להחלפה והוא אחד המרכיבים החשובים ביותר המהווים את הבסיס למערכות חיות, כלומר הוא אורגנוגן. חמצן הוא חלק ממספר עצום של מולקולות, החל מהפשוטות ביותר ועד ביופולימרים. תפקידו של החמצן בתהליכי החיים הוא רב, שכן החמצון של חומרים מזינים (פחמימות, חלבונים, שומנים) עם חמצן משמש כמקור אנרגיה הנחוץ לתפקודם של איברים ורקמות של יצורים חיים. רוב תגובות החיזור בגוף מתרחשות בהשתתפות חמצן וצורותיו הפעילות. התפקודים הפגוציטים (המגנים) של הגוף קשורים גם בנוכחות חמצן, וירידה בתכולת החמצן בגוף מפחיתה את תכונות ההגנה שלו. בפגוציטים (תאים המסוגלים ללכוד ולעכל גופים זרים), חמצן 02 מופחת לסופראוקסיד. בפרקטיקה הרפואית, חמצן משמש לשאיפה במצבים כואבים המלווים בחוסר חמצן (היפוקסיה), מחלות של דרכי הנשימה, מערכת הלב וכלי הדם, הרעלה עם פחמן חד חמצני (II) CO, חומצה הידרוציאנית HCN, כמו גם במחלות עם פגיעה במערכת הנשימה. פוּנקצִיָה. חמצון היפרברי נמצא בשימוש נרחב בפרקטיקה הקלינית - שימוש בחמצן בלחץ גבוה. שינוי אלוטרופי של חמצן - אוזון O3, כחומר מחמצן חזק מאוד, משמש לחיטוי מקום, חיטוי אוויר וטיהור מי שתייה. מבחינת תכולה בגוף האדם (0,16%), גופרית מסווגת כמקרו-נוטריינט. כמו חמצן, הוא חיוני. הדרישה היומית של מבוגר לגופרית היא כ-4-5 גרם גופרית היא חלק מביומולקולות רבות - חלבונים, חומצות אמינו (ציסטין, ציסטאין, מתיונין ועוד), הורמונים (אינסולין), ויטמינים (ויטמין B1). הרבה גופרית מצויה בקרוטן בשיער, בעצמות וברקמות העצבים. באורגניזמים חיים, גופרית, שהיא חלק מחומצות אמינו, מתחמצנת. התוצרים הסופיים של תהליך זה הם בעיקר סולפטים. בנוסף נוצרים תיוסולפטים, גופרית צמנט וחומצות פוליתיוניות. לפי תוכן בגוף (10-5-10-7%) סלניום הוא מיקרו-אלמנט. יש חוקרים שמסווגים אותו כמרכיב חיוני. סלניום מגיע ממזון - 55-110 מ"ג לשנה. סלניום מרוכז בעיקר בכבד ובכליות. ריכוז הסלניום בדם הוא 0,001-0,004 mmol/l. הקשר בין סלניום וגופרית באורגניזמים חיים אינו מוטל בספק. במינונים גדולים סלניום מצטבר בעיקר בציפורניים ובשיער, המבוססים על חומצות אמינו המכילות גופרית. ידועה גם היכולת של סלניום להגן על הגוף מפני הרעלה על ידי כספית Hg וקדמיום Cd. סלניום מקדם את הקישור של מתכות רעילות אלו לאתרים פעילים אחרים, כאלו שאינם מושפעים מהשפעותיהם הרעילות. עובדה מעניינת היא הקשר בין גבוה סלניום בתזונה לבין תמותה נמוכה מסרטן. במינונים גדולים, סלניום רעיל. פירוק תרכובות סלניום בבעלי חיים מוביל לשחרור דימתיל-סלניום רעיל ביותר, בעל ריח שום. 52. תפקיד ביולוגי של אלמנטים p של קבוצה VIIA. השימוש בתרכובות שלהם ברפואה (פלואור וכלור) מבחינת תכולה בגוף האדם, כלור (0,15%) שייך למקרו-אלמנטים, בעוד שהיסודות הנותרים מקבוצה זו הם מיקרו-אלמנטים (תוכן - 105 אחוזים. הלוגנים בצורת תרכובות שונות הם חלק מרקמות אדם ובעלי חיים. כלור ויוד הם יסודות חיוניים, בעוד השאר הם מרכיבים קבועים של רקמות. מסת הפלואור בגוף האדם היא בערך 7 מ"ג (~105 אחוזים. תרכובות פלואור מרוכזות ברקמת העצם, הציפורניים והשיניים. הרכב השיניים כולל כ-0,01% פלואוריד, ורובו באמייל, הנובע מהימצאותו של פלואורפטיט מסיס מעט בו. חוסר פלואוריד בגוף מוביל לעששת. העניין בהשפעות הביולוגיות של הפלואור קשור בעיקר לבעיית מחלות שיניים, שכן הפלואור מגן על השיניים מעששת. הבסיס המינרלי של רקמות השיניים (דנטין) מורכב מהידרוקסיאפטיט, כלורפטיט ופלואורפטיט. לעתים קרובות מאוד, לא המשטח החיצוני של השן, המכוסה בשכבת אמייל, נהרס, אלא האזורים הפנימיים של הדנטין, שנחשפים כאשר האמייל ניזוק. ישנן הצעות כי בעוד שהאמייל פגום רק מעט, הכנסת נתרן פלואוריד מעודדת היווצרות של פלואורפטיט, ומקלה על ה-remineralization של הנזק שהחל. נתרן פלואוריד NaF משמש בפרקטיקה רפואית כסוכן חיצוני אקטואלי. השימוש ב-NaF מבוסס על היווצרות פלואורפטיט. במקביל, סביבת חלל הפה היא בסיסית, מה שעוזר לנטרל את החומצות המיוצרות על ידי חיידקים. לא רק מחסור, אלא גם עודף של פלואוריד מזיק. כאשר תכולת הפלואוריד במי השתייה גבוהה מהנורמה המקסימלית המותרת (1,2 מ"ג/ליטר), אמייל השן הופך שביר, נהרס בקלות ומופיעים תסמינים נוספים של הרעלת פלואוריד כרונית - שבריריות עצם מוגברת, עיוותים בעצמות ותשישות כללית של הגוף. . המחלה המופיעה במקרה זה נקראת פלואורוזיס (פלוארוזיס). גוף האדם מכיל כ-100 גרם (2790 מילימול) של כלור. כלורידיונים ממלאים תפקיד ביולוגי חשוב. הם מפעילים כמה אנזימים, יוצרים סביבה נוחה לפעולתם של אנזימים פרוטוליטיים של מיץ קיבה, מספקים זרימות יונים דרך ממברנות התא ומשתתפים בשמירה על איזון אוסמוטי. לכלורידיון יש רדיוס אופטימלי לחדירה דרך קרום התא. זה בדיוק מה שמסביר את השתתפותו המשותפת עם יוני Na ו-K ביצירת לחץ אוסמוטי מסוים ובוויסות חילוף החומרים של מים-מלח. הדרישה היומית לנתרן כלורי היא 5-10 גרם. כפי שכבר נאמר, NaCl נחוץ לייצור חומצה הידרוכלורית בקיבה. בנוסף לתפקידה החשוב של חומצה הידרוכלורית בתהליך העיכול, היא משמידה חיידקים פתוגניים שונים (כולרה, טיפוס). אם חיידקים נכנסים לקיבה עם כמות גדולה של מים, אז בגלל דילול, ל-HCl אין השפעה אנטיבקטריאלית, והחיידקים שורדים. זה מוביל למחלות בגוף. לכן, במהלך מגיפות, מים גולמיים מסוכנים במיוחד. אם אין כמות מספקת של חומצה הידרוכלורית בקיבה, ה-pH עולה והעיכול התקין מופרע, מה שיש לו השפעה חמורה על בריאות האדם. כאשר החומציות של מיץ הקיבה נמוכה, נעשה שימוש בתמיסה מדוללת של חומצה הידרוכלורית בפרקטיקה הרפואית. עם דלקת של הקיבה (גסטריטיס) או כיב פפטי, הפרשת מיץ הקיבה עולה וחומציותו. 53. תפקיד ביולוגי של אלמנטים p של קבוצה VIIA. השימוש בתרכובות שלהם ברפואה (ברום, יוד) מסת הברום בגוף האדם היא כ-7 מ"ג. הוא ממוקם בעיקר בבלוטות האנדוקריניות, בעיקר בבלוטת יותרת המוח. התפקיד הביולוגי של תרכובות ברום בתפקוד התקין של הגוף עדיין לא הובהר מספיק. תרכובות ברום מעכבות את תפקוד בלוטת התריס ומגבירות את פעילות קליפת האדרנל. כאשר ברומידיונים מוכנסים לגוף, מערכת העצבים המרכזית רגישה ביותר. ברומידיונים מצטברים באופן שווה בחלקים שונים של המוח ויש להם השפעה מרגיעה במקרים של ריגוש מוגברת. הם עוזרים להחזיר את האיזון המופרע בין תהליכי עירור ועיכוב. ברומידיונים נספגים בקלות ממערכת העיכול. הרעילות של ברומידיונים נמוכה. עקב סילוק איטי מהגוף (תוך 30-60 יום), הם יכולים להצטבר (להצטבר), מה שמוביל להתפתחות הרעלה כרונית, הנקראת ברומזם. אם מופיעים סימנים של הרעלת ברום כרונית, יש להפסיק מיד לקחת תכשירי ברומיד. בנוסף, ניתנות כמויות גדולות של נתרן כלורי (עד 25 גרם ליום) כדי להגביר את קצב השחרור של ברומידונים (עקרון Le Chatelier), ורושמים שתייה מרובה. בשל רגישות אינדיבידואלית שונה, המינון של תכשירי ברום משתנה בין 0,05 ל-2,0 גרם. יוד הוא אחד ממרכיבי התזונה החיוניים ולתרכובותיו תפקיד חשוב בתהליכים מטבוליים. יוד משפיע על סינתזה של חלבונים, שומנים והורמונים מסוימים. גוף האדם מכיל כ-25 מ"ג של יוד. מתוך כמות היוד הכוללת בגוף, יותר ממחצית נמצא בבלוטת התריס. כמעט כל היוד הכלול בבלוטה זו נמצא במצב קשור (בצורת הורמונים) ורק כ-1% ממנו הוא בצורת יודיון. בלוטת התריס מסוגלת להתרכז פי 25 של I- בהשוואה לתכולתה בפלזמה. בלוטת התריס מפרישה את ההורמונים תירוקסין וטריודוטירונין. פעילות מופחתת של בלוטת התריס (היפותירואידיזם) עשויה להיות קשורה לירידה ביכולתה לצבור יוני יוד, וכן לחוסר יוד בתזונה (זפק אנדמי). עבור זפק אנדמי, תכשירי יוד נקבעים: (אשלגן יודיד KI או נתרן יודיד NaI) במינונים התואמים את הצורך היומי של אדם ביוד (0,001 גרם יודיד אשלגן). באזורים בהם קיים מחסור ביוד מוסיפים למלח השולחן NaI או K למניעת זפק אנדמי! (1-2,5 גרם ל-100 ק"ג). כאשר בלוטת התריס פעילה יתר על המידה (היפר-תירואידיזם), עקב סינתזה מוגזמת של הורמוני בלוטת התריס, נצפה קצב מוגבר באופן חריג של תהליכים מטבוליים. אם תרופות אלו אינן יעילות, יוד רדיואקטיבי 131 I משמש לטיפול בהיפרתירואידיזם, שקרינתו הורסת את זקיקי בלוטת התריס ובכך מפחיתה את עודף הסינתזה של הורמונים. כל היסודות מקבוצה VIIA פעילים מבחינה פיזיולוגית, וכלור ויוד הם הכרחיים לחיי הגוף. פלואור נחשב מרכיב הכרחי לתפקוד תקין של אורגניזמים חיים. בגוף, הלוגנים ניתנים להחלפה, ונצפו מקרים של סינרגיזם ואנטגוניזם כאחד. 54. אירוסולים אירוסולים הם מערכות מפוזרות עם תווך פיזור גזי. בהתאם למצב הצבירה של השלב המפוזר, נבדלים ערפילים - אירוסולים עם שלב מפוזר נוזלי; אדים, אבק - אירוסולים עם שלב מפוזר מוצק; ערפיח - אירוסולים עם שלב מפוזר מעורב. גדלי החלקיקים של השלב המפוזר של אירוסולים, בהתאם לסיווג המערכות המפוזרות, נעים בין 107 ל109 מ ' כמו מערכות פיזור אחרות, אירוסולים מיוצרים בשתי שיטות: עיבוי ופיזור. שיטת עיבוי הפאזה המפוזרת מתקבלת משלב האדים על ידי תהליך פיסיקלי של עיבוי מולקולות לחלקיקים בגודל קולואידי. שיטות פיזור חלקיקים בגודל קולואידי מתקבלים על ידי טחינת אגרגטים גדולים יותר. לארוסולים יש את היכולת לפזר אור. לחלקיקים מהפאזה המפוזרת של אירוסולים אין שכבה חשמלית כפולה, עם זאת, חלקיקים מהפאזה המפוזרת נושאים לעתים קרובות מטען חשמלי. המטען נוצר כתוצאה מחיכוך או עקב ספיחת יוני גזים. יש לציין כי לעתים קרובות מאוד חלקיקי אירוסול (קטנים וגדולים) נושאים מטען של סימן הפוך. הפרדת חלקיקים לפי גודל בנפחים גדולים של אירוסולים לפי גובה יכולה להוביל להופעתו של שדה חשמלי בעוצמה גבוהה. כך נוצרת פריקה חשמלית בעננים - ברק. אירוסולים הם מערכות לא יציבות מבחינה קינטית ואגרגציה, שכן אין שכבה חשמלית כפולה בגבול הפאזה. לכן, אירוסולים מקרישים בקצב מהיר יותר מאשר ליוסולים. ברפואה, אירוסולים משמשים לטיפול באינהלציה, להגנה על עור פגום ולחיטוי. לפעמים היווצרות אירוסולים היא מאוד לא רצויה. אירוסולים המסוכנים לבריאות האדם נוצרים בבתי יציקה, בקרמיקה ובמהלך הפקה ועיבוד של מינרלים שונים (עפרה, פחם, אסבסט וכו'). אירוסולים המכילים חלקיקי פחם גורמים למחלות ריאות - אנתרקוזיס, תחמוצת סיליקון (IV) - סיליקוזיס, אסבסט - אסבסטוזיס. מחלות אלרגיות נגרמות מאירוסולים הנוצרים מאבקת צמחים, אבק שנוצר במהלך עיבוד כותנה, פשתן, קנבוס ועוד. תרחיפים של חיידקים, עובשים ווירוסים – אירוסולים מיקרוביולוגיים או חיידקיים – הם אחד מדרכי ההעברה של מחלות זיהומיות: ריאות. שחפת, שפעת, מחלות נשימה חריפות. אירוסולים הנוצרים במהלך שריפת הדלק, שהשלב המפוזר בו מורכב מפיח, שרפים, אפר ופחמימנים מסרטנים, משפיעים מזיקה על גוף האדם. ערפיח מסוכן במיוחד לבריאות. לכן, המאבק נגד אבק וזיהום אטמוספירה הופך חשוב יותר ויותר. טיהור אוויר מאירוסולים מושג על ידי הכנסת טכנולוגיות נטולות פסולת - לכידת חלקיקים מהפאזה המפוזרת באמצעות מסננים, ציקלונים (קולטי אבק צנטריפוגליים), ושדה חשמלי במתח גבוה. 55. תחליבים אמולסיות הן מערכות מיקרו-הטרוגניות שבהן הפאזה המפוזרת ומדיום הפיזור הם נוזלים בלתי ניתנים לערבב. גדלים של חלקיקים של הפאזה המפוזרת - טיפות נוזלים - נעים בין 104 ל-106 מ'. בהתאם לריכוז השלב המפוזר, נבדלים תחליבים: מדוללים, מרוכזים ומרוכזים מאוד. בהתאם לאופי השלב המפוזר ומדיום הפיזור, נבדלים הבאים: 1) תחליבים של נוזל לא קוטבי (DF) בנוזל קוטבי (DS) - תחליבים ישירים, המכונים תחליבים מהסוג הראשון או תחליב שמן/מים (O/W); 2) תחליבים של נוזל קוטבי (PF) בנוזל לא קוטבי (DS) - תחליבים הפוכים, הנקראים תחליבים מהסוג השני או תחליב מים/שמן (W/O). כאן DF ו-DS הם הפאזה המפוזרת ומדיום הפיזור, בהתאמה, "מים" הם כל נוזל קוטבי, "שמן" אינו קוטבי. ניתן להגדיר את סוג האמולסיה: 1) מדידת מוליכות חשמלית; 2) ערבוב עם עודף של נוזל קוטבי או לא קוטבי; 3) צביעה בצבעים מסיסים במים או מסיסים בשמן; 4) על ידי הרטבה ופיזור טיפת אמולסיה על משטח הידרופובי או הידרופילי. תחליבים, כמו מערכות פיזור אחרות, יכולות להיות מתקבל בשיטות עיבוי ופיזור. תחליבים כפיזור גס הם מערכות לא יציבות מבחינה קינטית וצבירה. כאשר טיפות של הפאזה המפוזרת מתנגשות, הן מתמזגות (התלכדות). כתוצאה מהתלכדות, האמולסיה נפרדת לשני שלבים נוזליים רציפים. כדי להגביר את יציבות האמולסיות, משתמשים במייצבים - מתחלבים. אלו הם פעילי שטח שכתוצאה מהספיחה בממשק מפחיתים את מתח הממשק ויוצרים סרט ספיחה חזק מבחינה מכנית. אם מתחלב הוא חומר פעיל שטח יוני, אז הוא מעניק מטען חשמלי מאותו סימן לטיפות הפאזה המפוזרת, והטיפות דוחות. סוג האמולסיה שנוצרת תלוי בתכונות התחליב. מדיום הפיזור הוא תמיד הנוזל שממיס או מרטיב את המתחלב בצורה טובה יותר. מלחים של חומצות שומן גבוהות יותר, אסטרים של חומצות שומן גבוהות יותר ואלכוהולים רב-הידריים ואמינים ארוכי שרשרת משמשים כמתחלבים. אמולסיות נמצאות רבות בטבע. תחליבים כוללים חלב, שמנת, שמנת חמוצה, חמאה, חלמון ביצה, מוהל צמחי חלבי ושמן גולמי. תחליבים המכילים חומרים רפואיים נמצאים בשימוש נרחב ברפואה: הסוג הראשון (O/W) לשימוש פנימי, הסוג השני (W/O) לשימוש חיצוני. ידוע כי שומנים צמחיים ובעלי חיים נספגים טוב יותר בגוף בצורה מתחלבת (חלב). במקרה זה, נגזרות של חומצה כולית ודאוקסיכולית פועלות כמתחלבים. לפעמים יש צורך להרוס את האמולסיה שנוצרה. שבירת האמולסיה נקראת דמולסיפיקציה. הדמולסיפיקציה מתבצעת על ידי העלאה והורדה של הטמפרטורה, חשיפה לשדה חשמלי, צנטריפוגה, והוספת אלקטרוליטים וחומרים מיוחדים - ממיסים. ממיסים הם חומרים פעילי שטח בעלי פעילות פני השטח גדולה יותר מאשר מתחלבים, אך אין להם את היכולת ליצור שכבת ספיחה חזקה מבחינה מכנית. 56. חומרים פעילי שטח קולואידים חומרים פעילי שטח קולואידים הם חומרים שעם אותו ממס, בהתאם לתנאים, יוצרים תמיסה אמיתית וקולואידית. כפי שכבר הוזכר, מולקולות פעילי שטח הן אמפיפיליות. הם מורכבים מקבוצות לא קוטביות וקוטביות. לרדיקלים לא קוטביים, למשל, שרשראות פחמימנים, אין זיקה לממס הקוטבי - מים; עבור קבוצות קוטביות היא גבוהה למדי. קיימת אינטראקציה הידרופוביה (ואן דר ואלס) בין קבוצות לא קוטביות. עם אורך שרשרת של כ-1022 אטומי פחמן, עקב האינטראקציות ההידרופוביות של רדיקלים פחמימנים והאינטראקציה החזקה של קבוצות קוטביות עם מים, מתרחשת האסוציאציה של מולקולות פעילי שטח ונוצרים מיצלות. הריכוז המינימלי של חומר פעיל שטח קולואידי, שממנו נוצרות מיצלות בתמיסתו, נקרא ריכוז המיצל הקריטי (CMC). צורת המיצלות המתקבלות תלויה בריכוז התמיסה. בריכוזים נמוכים של חומר פעיל שטח קולואידי נוצרות מיצלות כדוריות. עלייה בריכוז של תמיסת פעיל שטח קולואידית מובילה תחילה לעלייה במספרם, ולאחר מכן לשינוי צורה. בריכוזים גבוהים יותר, במקום מיצללים כדוריים, נוצרים מיצללים גליליים ולמלרים. הערך של CMC תלוי בגורמים שונים: אופי חומר השטח הקולואידי, טמפרטורה ונוכחות של זיהומים של חומרים זרים, במיוחד אלקטרוליטים. ניתן לקבוע CMC על פי תכונות התמיסה, בהתאם למספר וגודלם של חלקיקים פעילים קינטית, במיוחד על ידי שינויים בלחץ האוסמוטי, מתח פני השטח, מוליכות חשמלית ומאפיינים אופטיים. מכיוון שבמהלך המעבר "תמיסה אמיתית - תמיסה קולואידלית" גודלם של חלקיקים פעילים קינטית (יונים, מולקולות, מיצלות) ומספרם משתנה, מופיעה נקודת פיתול התואמת ל-CMC בגרף "תכונה - ריכוז". אחת התכונות החשובות ביותר של תמיסות פעילי שטח קולואידים, שבגללה הן נמצאות בשימוש נרחב במגזרים שונים של הכלכלה הלאומית וברפואה, היא ממיסות. מנגנון ההמסה הוא פירוק של חומרים לא קוטביים בליבה ההידרופוביה של מיצלות. תופעת ההמסה נמצאת בשימוש נרחב במגזרים שונים בכלכלה הלאומית: בתעשיית המזון, בתעשיית התרופות (להשגת צורות נוזליות של חומרים רפואיים). במערכת המים-פוספוליפידים, ניעור וערבול יוצרים מיצלות כדוריות - ליפוזומים. מולקולות פוספוליפיד יוצרות ממברנה דו-שכבתית בליפוזומים, שבה קבוצות קוטביות פונות למים וקבוצות לא קוטביות זו מול זו. ליפוזומים יכולים להיחשב כמודל של ממברנות ביולוגיות. בעזרתם ניתן לחקור את חדירות הממברנות והשפעת גורמים שונים עליה עבור תרכובות שונות. ליפוזומים נמצאים בשימוש נרחב לאספקה ממוקדת של תרופות לאיברים מסוימים או לאזורים מושפעים. ניתן להשתמש בליפוזומים כדי להעביר תרופות לתאים. ממברנות ליפוזומליות משמשות במחקר אימונולוגי כדי לחקור את האינטראקציה בין נוגדנים ואנטיגנים. מחברים: Drozdova M.V., Drozdov
עור מלאכותי לחיקוי מגע
15.04.2024 פסולת חתולים של Petgugu Global
15.04.2024 האטרקטיביות של גברים אכפתיים
14.04.2024
▪ חלק של האתר אפוריזמים של אנשים מפורסמים. מבחר מאמרים ▪ מאמר חפירה צינורית. ציור, תיאור ▪ מאמר איך דגים נושמים? תשובה מפורטת ▪ מאמר רתך חשמלי גז. הוראה סטנדרטית בנושא הגנת העבודה ▪ מאמר גלאי מתכות טרנזיסטור פשוט. אנציקלופדיה של רדיו אלקטרוניקה והנדסת חשמל
בית | הספרייה | מאמרים | <font><font>מפת אתר</font></font> | ביקורות על האתר www.diagram.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese

 ראה מאמרים אחרים סעיף
ראה מאמרים אחרים סעיף 